Modèle Excel — Master Manufacturing Record & Master Batch Record
Recommandés
Le secteur pharmaceutique constitue une véritable colonne vertébrale sanitaire, et dépasse le simple maillon de la chaîne industrielle. Ici, chaque geste est réglementé, chaque document contrôlé, chaque production auditée. Le cœur du métier repose sur une logique triptyque : qualité, sécurité, efficacité. C’est ce qui fait la différence entre une simple production de comprimés et une fabrication pharmaceutique conforme aux Bonnes Pratiques de Fabrication (BPF/GMP).
Le professionnel pharmaceutique – qu’il soit technicien de production, ingénieur qualité ou responsable assurance – se trouve à la croisée de la biologie, de la chimie et de la réglementation internationale. L’enjeu ? Garantir que chaque lot fabriqué puisse être administré à un patient avec une confiance absolue.

Le jargon du métier : rigueur lexicale et maîtrise documentaire
L’univers pharmaceutique est riche en jargon technique qui en dit long sur la sophistication de la filière. On y retrouve notamment :
- MBR (Master Batch Record) : la « recette mère » du médicament. C’est un document maître qui décrit l’intégralité des étapes de fabrication, du pesage des matières premières à l’emballage final. Il est conçu en amont et validé par la Qualité.
- BRE (Batch Record Execution) : le carnet de bord opérationnel, qui trace en temps réel les données du lot produit, avec signatures et horodatages.
- CAPA (Corrective and Preventive Actions) : système de traitement des déviations et anomalies pour éviter la récurrence.
- IPC (In-Process Controls) : contrôles en cours de fabrication qui garantissent la conformité avant de passer à l’étape suivante.
- Deviation Log, Change Control, QA Release : autant de vecteurs documentaires qui rappellent que dans ce métier, l’encre est presque aussi importante que la poudre.
Cette grammaire professionnelle, parfois perçue comme une lourdeur, est en réalité le socle de la confiance publique.
Les vecteurs du métier : ce qui structure l’excellence
L’activité pharmaceutique s’appuie sur plusieurs vecteurs structurants qui façonnent l’identité du métier :
- La traçabilité : grâce aux Master Batch Records, chaque lot est une « histoire » documentée. Rien n’est laissé au hasard.
- La conformité réglementaire : FDA, EMA, OMS, ANSM… chaque organisme impose un cadre strict. Les métiers pharmaceutiques naviguent dans un environnement mondial où la norme est un langage commun.
- La qualité intégrée : l’assurance qualité (QA) n’est pas un service isolé, mais une culture quotidienne. Le moindre opérateur sur ligne est un acteur qualité.
- La gestion des risques : via les déviations, les CAPA et les AMDEC, l’industrie s’auto-évalue en permanence pour prévenir toute dérive.
- La digitalisation : l’émergence des e-Batch Records (MBR électroniques) transforme la manière de travailler, accélérant l’exécution tout en renforçant la fiabilité des données.
Des compétences hybrides
Le métier pharmaceutique n’est pas réservé aux seuls docteurs en pharmacie. On y retrouve :
- des ingénieurs procédés capables de traduire une formule en séquence industrielle ;
- des techniciens de production formés aux contrôles critiques et au travail en zones classées ;
- des spécialistes qualité qui orchestrent la documentation et les audits ;
- des informaticiens réglementaires qui déploient les solutions de traçabilité digitale (ERP, LIMS, MES).
Le dénominateur commun : la discipline documentaire et scientifique. Ici, une signature engage la responsabilité, un écart peut coûter une autorisation de mise sur le marché (AMM).
Un métier d’engagement
Parler du métier pharmaceutique, c’est évoquer un univers où le détail devient stratégique. Derrière chaque comprimé avalé par un patient se cache une chaîne humaine et documentaire d’une rigueur extrême.
Le Master Batch Record n’est pas qu’un classeur technique : c’est le symbole de cette promesse de qualité et de sécurité. Dans une époque marquée par la recherche d’innovation rapide, il demeure l’un des vecteurs essentiels qui rappelle que l’exigence pharmaceutique est, avant tout, un acte de confiance envers le patient.
📘 Master Batch Record (MBR) – Votre “recette mère”
Le Master Batch Record (MBR) est en quelque sorte la recette officielle de votre produit.
Imaginez : avant de cuisiner, vous préparez une fiche où sont listés tous les ingrédients, les quantités exactes, les étapes pas à pas et même les critères de qualité pour vérifier que le plat final est réussi.
Ici, c’est pareil, mais pour vos médicaments.
Ce que vous trouvez dedans
- Page de garde : le nom du produit, la force (ex. 500 mg), le code, la version, le statut (Draft, Approved…).
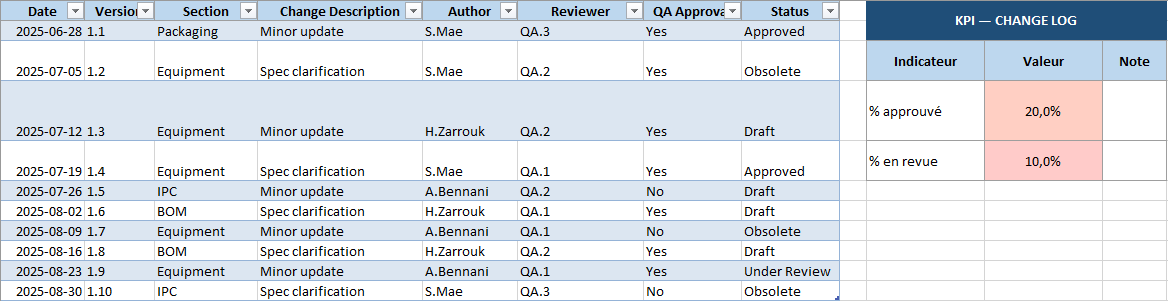
- Change Log : le journal des modifications pour garder l’historique des versions.
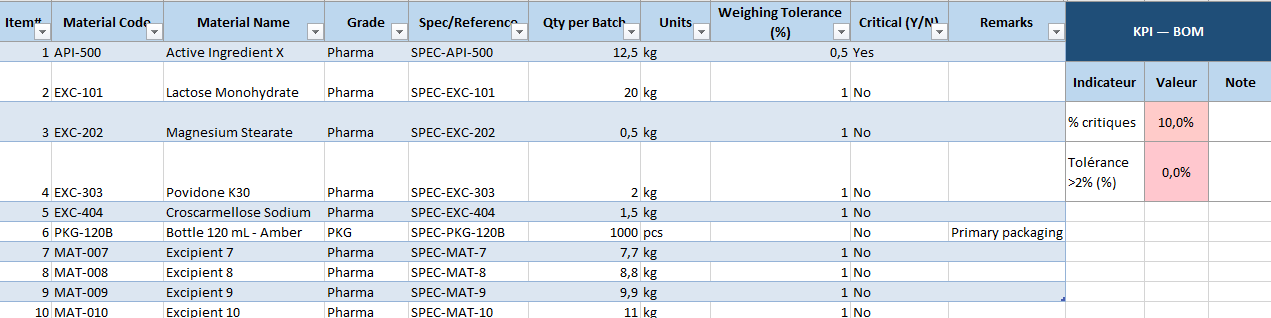
- BOM (Bill of Materials) : la liste complète des matières premières et excipients, avec quantités et tolérances.
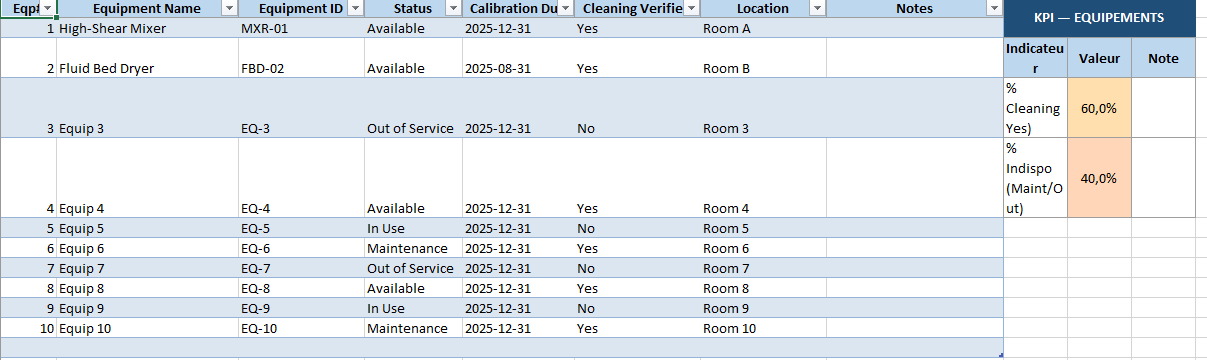
- Équipements : chaque machine nécessaire, son statut et sa vérification.
- Instructions de fabrication : étapes SOP détaillées avec paramètres critiques.
- IPC Specs : les contrôles à faire en cours de process (poids, uniformité, dissolution…).
- Déviations & CAPA : tableau pour tracer les anomalies et actions correctives.
- Packaging & Labels : description des composants d’emballage et leur approbation.
- Signatures : les rôles (Auteur, QA, Production Head) pour valider le document.
- KPI par feuille : petits indicateurs automatiques (ex. % Specs approuvées, % équipements propres) pour un suivi rapide.
Comment vous l’utiliser
- Vous, en tant qu’utilisateur, pouvez préparer un nouveau produit en remplissant ces sections pas à pas.
- Le MBR vous sert de cadre officiel validé par la qualité, que vous allez réutiliser chaque fois qu’un lot doit être fabriqué.
- Considérez-le comme votre plan directeur : il est fixe, stable et vérifié par QA.

📗 Batch Record Execution (BRE) – Votre “journal de bord”
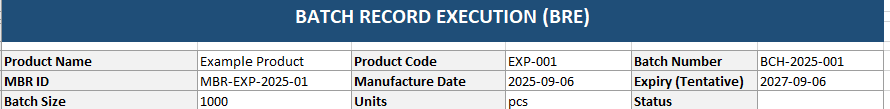
Le Batch Record Execution (BRE) est le carnet de bord du lot. Si le MBR est la recette, le BRE est le journal où vous cochez chaque étape pendant que vous cuisinez réellement.
Ce que contient le fichier :
- Batch Header : infos spécifiques au lot (numéro de lot, date de fabrication, taille du lot).
- Weighing Log : enregistrement de chaque pesée, avec tolérances auto-calculées (Yes/No).
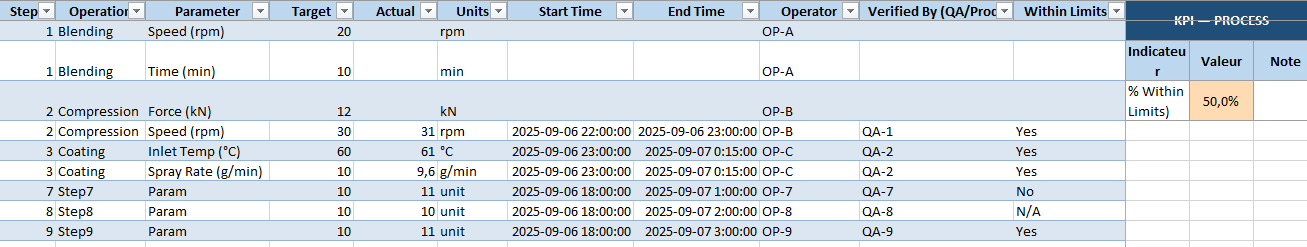
- Process Log : suivi de chaque étape (paramètres cibles vs valeurs réelles).
- IPC Log : résultats des tests en cours de production (Pass/Fail).
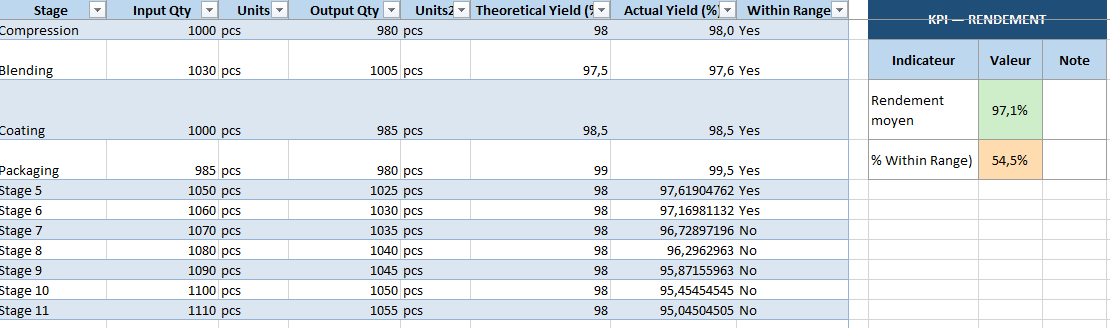
- Yield & Reconciliation : calcul automatique du rendement (input vs output).
- Cleaning & Clearance : validation du nettoyage et de la ligne avant production.
- Packaging : suivi des consommations de composants d’emballage.
- Déviations : anomalies détectées pendant le lot.
- QA Release : check final avec décision de libération (Release, Reject, Quarantine).
- Audit Trail : traçabilité des modifications.
- KPI par feuille : % de pesées dans tolérance, % IPC passés, rendement global, % déviations closes…
Comment vous l’utiliser
- Vous, en tant qu’utilisateur, remplissez le BRE en temps réel : chaque opérateur note ses pesées, ses paramètres, ses observations.
- Le BRE est donc unique pour chaque lot : il reflète la réalité du terrain.
- À la fin, la QA s’appuie sur ce document pour décider de la libération du lot.
🔑 La différence en un coup d’œil
- MBR = Document maître : une fois validé, il change rarement. Il définit le “quoi” et le “comment”.
- BRE = Document d’exécution : il change à chaque lot. Il prouve le “fait” et le “quand”.
==> Vous, utilisateur, utilisez le MBR comme référence et le BRE comme preuve. L’un est le plan, l’autre est le film de l’exécution.
🔍 Comparaison MBR vs BRE
1. La nature du document
- MBR (Master Batch Record) : c’est le document maître. Vous pouvez le voir comme la recette officielle, définie une fois pour toutes, validée par la qualité.
- BRE (Batch Record Execution) : c’est le document d’exécution. Vous le remplissez en temps réel, lot par lot, pour prouver ce qui a été effectivement fait.
👉 En résumé : MBR = la théorie / BRE = la pratique.
2. Le moment d’utilisation
- MBR : utilisé en amont, avant de produire, pour cadrer et standardiser la méthode.
- BRE : utilisé pendant et après la production, comme un carnet de bord qui suit la vie du lot.
3. Le contenu
- MBR contient :
- La liste des matières (BOM)
- Les équipements nécessaires
- Les instructions étape par étape
- Les spécifications à respecter
- Les signatures de validation (QA, Production, etc.)
- BRE contient :
- Les pesées réelles et les contrôles tolérance
- Les paramètres process cibles vs réels
- Les résultats IPC (Pass/Fail)
- Le rendement calculé automatiquement
- Les déviations détectées et leur traitement
- La décision finale de libération du lot
4. La responsabilité
- MBR : validé par la Qualité et souvent révisé par plusieurs niveaux (Auteur, Reviewer, QA).
- BRE : rempli par vous et vos collègues opérateurs au quotidien. Chaque signature engage la responsabilité de la personne qui exécute.
5. Les KPI intégrés (dans vos fichiers Excel)
- MBR → vous voyez des indicateurs comme :
- % de spécifications approuvées
- % d’équipements nettoyés
- % de CAPA clôturées
- BRE → vous suivez en direct :
- % de pesées dans tolérance
- % de paramètres dans les limites
- % de tests IPC passés
- Rendement global du lot
- Déviations clôturées
Ce qu’il faut retenir (message pour vous)
- Utilisez le MBR comme référence : il vous donne le cadre, la norme, la méthode validée.
- Remplissez le BRE comme preuve : il raconte l’histoire unique de votre lot, étape par étape.
- Les deux documents sont complémentaires : sans MBR, pas de standard ; sans BRE, pas de traçabilité.
Présentation du modèle Word — Master Manufacturing Record & Master Batch Record
Une trame claire et pratique
Ce document a été conçu pour vous offrir un support simple et structuré. L’idée est que vous puissiez y consigner, étape par étape, toutes les données nécessaires à la préparation d’un Master Manufacturing Record (MMR) et d’un Master Batch Record (MBR).
Chaque partie est organisée sous forme de tableaux avec des en-têtes colorés, ce qui rend la lecture et la saisie beaucoup plus agréables.
Les rubriques principales
1. Informations générales
Une première table vous permet d’indiquer les éléments d’identité du produit :
- nom et code produit,
- dosage et forme pharmaceutique,
- version, date de diffusion, responsables de l’émission et de l’approbation.
C’est ici que vous fixez le cadre du document.
2. Bill of Materials (BOM)
Un tableau à six colonnes où vous pouvez détailler les matières premières : numéro, code, désignation, spécifications, quantité et unité.
Dix lignes sont déjà prévues pour faciliter votre saisie.
3. Équipements requis
Une section réservée aux moyens matériels : nom de l’équipement, identifiant, statut (en service, maintenance…), date de prochaine calibration et remarques éventuelles.
Vous disposez d’assez de lignes pour recenser les équipements essentiels à votre production.
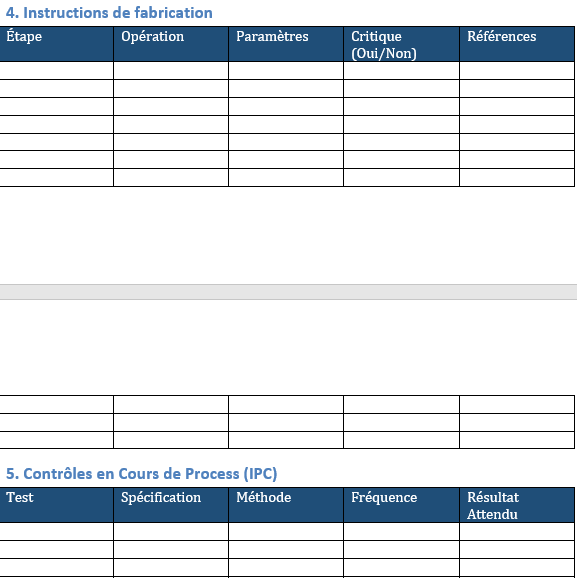
4. Instructions de fabrication
Un tableau destiné à décrire vos étapes de procédé : l’opération, les paramètres de réglage, le caractère critique de l’étape, ainsi que les références associées (procédures ou modes opératoires).
Une dizaine de lignes sont déjà prêtes à être renseignées.
5. Contrôles en cours de fabrication (IPC)
Ici, vous notez les tests réalisés pendant le process : spécifications, méthodes, fréquence et résultats attendus.
Huit lignes sont prévues, ce qui couvre les contrôles usuels.
6. Signatures
La dernière table est réservée aux validations : rôles (auteur, relecteur, QA, responsable production), nom, signature et date.
Cette partie formalise l’approbation du document.
Pourquoi ce format est utile
- Les couleurs différencient clairement les rubriques et évitent de se perdre dans les informations.
- Chaque tableau est pensé pour être pratique à remplir, soit à l’écran, soit sur papier.
- La structure vous accompagne depuis la définition du produit (MMR) jusqu’au suivi de lot (MBR).