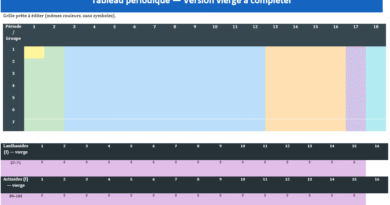
Tableau périodique vierge à Imprimer & PDF : l’algorithme visible de la matière
Recommandés
C’est un poster dans les salles de classe. C’est surtout la carte maîtresse de la chimie : le tableau périodique regroupe les éléments selon une logique qui fait émerger des régularités — réactivité, stabilité, conductivité — au point d’en devenir prédictif. Derrière ses cases, un récit scientifique : de l’intuition de Mendeleïev aux confirmations quantiques, jusqu’aux éléments superlourds synthétisés au XXIᵉ siècle.
En une phrase : la périodicité, c’est l’interface entre structure atomique et propriétés macroscopiques — un langage commun qui permet à la chimie de prévoir autant que de comprendre.
Un classement qui devance la découverte
En 1869, Dmitri Mendeleïev aligne les éléments connus par masses croissantes et ose des cases vides pour ceux qui manquent. Pari gagnant : le gallium, le scandium et le germanium arriveront exactement là où il les attendait.
En 1913, Henry Moseley remplace la masse par le numéro atomique (le nombre de protons) : la périodicité cesse d’être une intuition et devient une loi d’ordre électronique.
Architecture d’une table qui dit déjà beaucoup
- 7 périodes (lignes) : remplissage progressif des couches électroniques.
- 18 groupes (colonnes) : familles qui partagent une chimie voisine (mêmes électrons de valence).
- Blocs :
- s (alcalins, alcalino-terreux) : réactifs, donneurs d’électrons.
- p (non-métaux, halogènes, gaz nobles) : de l’oxydant féroce au chimiste le plus placide.
- d (métaux de transition) : catalyse, alliages, couleurs.
- f (lanthanides, actinides) : terres rares et nucléaire.
Cas à part : l’hydrogène, électron unique et double vie (proche des alcalins par configuration, des halogènes par affinité pour l’électron), et l’hélium, gaz noble malgré une configuration 1s².
Les grandes tendances (et ce qu’elles impliquent)
- Rayon atomique : diminue de gauche à droite (noyau attire davantage), augmente de haut en bas (couches ajoutées).
- Énergie d’ionisation : tendance inverse du rayon — plus l’atome est “compact”, plus il coûte cher d’arracher un électron.
- Électronégativité (Pauling) : monte vers le fluor (record), chute vers les métaux alcalins. Indice clé pour prévoir la polarité des liaisons.
- Métal → non-métal : un gradient, pas une frontière nette ; les métalloïdes (Si, Ge…) font le pont — et l’électronique moderne.
Ces gradients expliquent beaucoup : la vigueur du sodium dans l’eau, la passivité de l’or, la voracité du chlore, la noblesse de l’argon.
Exception, vous avez dit exception ?
La chimie réelle aime les entorses apparentes : configurations électroniques stabilisées (Cr, Cu), effet paire inerte chez les lourds (Tl, Pb, Bi), contradictions utiles comme l’hélium posé chez les gaz nobles. Le tableau n’est pas un dogme : c’est un cadre prédictif où les exceptions enseignent.
Ce que le tableau rend concret dans nos vies
- Énergie & stockages : Li (batteries), Ni/Co/Mn (cathodes), U/Pu (fission).
- Catalyse : Pt, Pd, Rh pour accélérer l’improbable (automobile, chimie fine).
- Électronique : Si et Ge (semi-conducteurs), Ga/As et Ga/N (optoélectronique).
- Aimants & moteurs : Nd, Dy (terres “rares” mais omniprésentes dans l’éolien, la robotique).
- Santé : Tc-99m (imagerie), I (thyroïde), Fe (hémoglobine), Zn/Mg (enzymes).
Les nouveaux venus et la frontière des superlourds
Le tableau compte aujourd’hui 118 éléments officiellement nommés, dont nihonium (113), moscovium (115), tennessine (117) et oganesson (118), confirmés dans les années 2010. Au-delà, les physiciens traquent une hypothétique “île de stabilité” : quelques noyaux superlourds qui survivraient assez longtemps pour livrer une chimie observable. La période 8 n’est pas encore sur les posters, mais elle est déjà sur les accélérateurs.
Mode d’emploi express : lire une case, lire une famille
- Numéro atomique = identité.
- Colonne = caractère chimique (réactivité, types de liaisons).
- Ligne = taille et écran électronique.
- Position diagonale = analogies utiles (ex. Li–Mg, Be–Al).
- Carte thermique : imaginez les gradients (rayon, électronégativité) qui traversent la table.
Le tableau périodique au travail : règles d’anticipation, bizarreries utiles et pistes pour créer des matériaux
Le poster a posé la carte. Voici l’étape d’après : s’en servir pour prévoir. Du rôle des électrons de valence aux effets relativistes, en passant par des raccourcis de conception (HSAB, relations diagonales), cette suite condense ce que les chimistes utilisent réellement quand ils passent du tableau à l’atelier.
1) Sous la périodicité, l’électron de valence
- Groupes = comportement : même enveloppe externe → réactivité voisine (alcalins donneurs, halogènes accepteurs).
- Charge effective (Z*): à gauche → électrons moins tenus (réactifs, métalliques) ; à droite → électrons serrés (oxydants, non-métaux).
- Écrantage & taille : descendre = couches ajoutées → rayon, polarizabilité, états d’oxydation élevés plus probables.
Règle express : plus l’électron de valence “voit” le noyau, plus l’atome retient ses électrons (ionisation ↑) et attire ceux d’autrui (électronégativité ↑).
2) Les « exceptions » qui servent (vraiment)
- Cr, Cu : demi-remplissage/remplissage de sous-couche 3d stabilise des configurations “déviantes” → chimie redox riche.
- Contraction des lanthanides : 4f mal écrantés → radii plus petits que prévu ; conséquences en catalyse, aimants, alliages.
- Effet paire inerte (Tl, Pb, Bi) : les ns² “restent assis” → états d’oxydation +1/+2 préférés.
- Relativiste (lourds) : Au apparaît doré (5d contractée), Hg liquide (liaison affaiblie). Loin d’un caprice : un levier de design.
3) Boîte à outils pour prédire sans calculatrice
HSAB (acide-base dur/mou).
- Durs : petits, peu polarisables (F⁻, O²⁻, Al³⁺) → liaisons ioniques, réseaux rigides.
- Mous : gros, polarisables (I⁻, S²⁻, Cu⁺, Pd²⁺) → liaisons covalentes, complexes souples.
Déclic : associer dur-dur, mou-mou pour stabiliser ; croiser pour réactivité.
Relations diagonales.
- (Li ↔ Mg), (Be ↔ Al) : taille/charge comparables → analogies de chimie (organolithiums vs. organomagnésiens, etc.).
Zintl & frontière métal/non-métal.
- Autour de la “marche” p-bloc : anions d’éléments normalement “métalliques” (polyanions de Si, Ge) → semi-conducteurs originaux.
Électronégativité & type de liaison.
- Δχ faible → covalent ; fort → ionique ; intermédiaire → polaire, donc directionnel (clé en matériaux).
4) Matériaux : du tableau au prototype
- Batteries (cathodes) : glissez le doigt sur 3d (Ti→Ni→Co→Mn) → potentiel redox évolue ; panachez stabilité (Mn), capacité (Ni), cinétique (Co).
- Pérovskites (ABX₃) : A gros / B plus petit / X = halogène ou oxygène. Le taux de tolérance (lié aux rayons ioniques) se lit à vue d’œil dans le tableau → formabilité probable.
- Catalyse “volcan” : d-bloc — l’énergie d’adsorption des intermédiaires (H*, O*, CO*) suit des tendances périodiques → choisir un sommet ou l’approcher par alliage/dopage.
- Aimants : 3d (Fe, Co) × 4f (Nd, Dy) → anisotropie + moment ; la contraction des lanthanides explique la performance.
5) Isotopes & origine cosmique : la périodicité racontée par les étoiles
- s-process (lent dans les géantes rouges), r-process (rapide en fusions d’étoiles à neutrons) : les abondances naturelles « sculptent » le tableau.
- Isotopes fonctionnels : Tc-99m (imagerie), B-10 (capture neutronique), C-13/N-15 (suivi isotopique). Même élément, chimie quasi identique, usages radicalement différents.
6) Lire une case… en mode expert
- États d’oxydation courants (Fe: +2/+3 ; Cu: +1/+2 ; S: −2,+6) → réflexe pour balances redox.
- Configuration condensée ([Ar] 3d⁵ 4s¹…) → indice sur la liaison, la couleur (d-d), le spin.
- Affinité électronique : halogènes hauts, métaux faibles → guides pour dopage n/p en semi-conduction.
7) Périodicité sous contrainte : pression, solution, surface
- Sous pression : métaux “insoupçonnés” (Na transparent, O métalloïde), structures exotiques (phases superioniques).
- En solution : solvatation rebat les cartes (acidité apparente, complexation).
- À la surface : un même métal change de visage selon la facette (catalyse, corrosion).
8) Malentendus courants
- « Tout est strictement périodique » → non : la tendance prévaut, les détails comptent.
- « L’hydrogène est un alcalin comme les autres » → non : caméléon (H⁺, H⁻, liaisons H).
- « Métal = conducteur, point » → non : métalloïdes et alliages modulaires brouillent la ligne.
9) Pour la classe, le labo, l’ingé : trois idées d’usage immédiat
- Carte thermique maison : coloriez votre tableau par une propriété (ionisation, rayon) → les gradients sautent aux yeux.
- Left-step (table “à gauche”) : réarrangez par sous-couches (s, f, d, p) → les blocs prennent sens pour l’électronique.
- Substitution raisonnée : cherchez d’abord dans le voisinage (même colonne/diagonale) avant d’explorer loin — règle qui économise semaines et budget.
10) À retenir, en trois lignes
- La périodicité est un algorithme visuel : elle propose des hypothèses et hiérarchise les essais.
- Les exceptions ne cassent pas la loi : elles la précisent (relativiste, paire inerte, contraction).
- Croisez valence, électronégativité, HSAB : vous prédirez déjà beaucoup de chimie réelle.