Guide pour la Création d’un QCM Énergie Interne
Recommandés
Ce guide vous aidera à structurer et à rédiger un questionnaire à choix multiples (QCM) sur le thème de l’énergie interne en physique – QCM énergie interne -. L’énergie interne est une notion fondamentale qui concerne l’énergie contenue dans un système thermodynamique en raison de la somme des énergies cinétique et potentielle des particules qui le composent.
Étape 1 : Définir les objectifs du QCM énergie interne
Avant de rédiger le QCM énergie interne, il est essentiel de savoir ce que vous souhaitez évaluer chez les étudiants. Voici quelques objectifs potentiels :
- Comprendre les principes de l’énergie interne dans un système.
- Connaître les facteurs influençant l’énergie interne (température, pression, volume, etc.).
- Appliquer les principes de thermodynamique à des exemples concrets.
- Interpréter les formules et les équations liées à l’énergie interne.
Étape 2 : Organiser les connaissances essentielles
Les questions du QCM énergie interne doivent couvrir les principaux concepts liés à l’énergie interne :
- Définition de l’énergie interne : Quelle est l’énergie interne et comment se distingue-t-elle des autres formes d’énergie ?
- Facteurs influençant l’énergie interne : Le rôle de la température, de la chaleur et du travail.
- Relations mathématiques : Utilisation de l’équation de la première loi de la thermodynamique (ΔU = Q – W).
- Applications pratiques : Étudier des systèmes concrets comme les gaz parfaits et leur énergie interne en fonction de la température.
- Différences entre énergie interne et autres types d’énergie (énergie thermique, énergie mécanique, etc.).
Étape 3 : Structurer le QCM
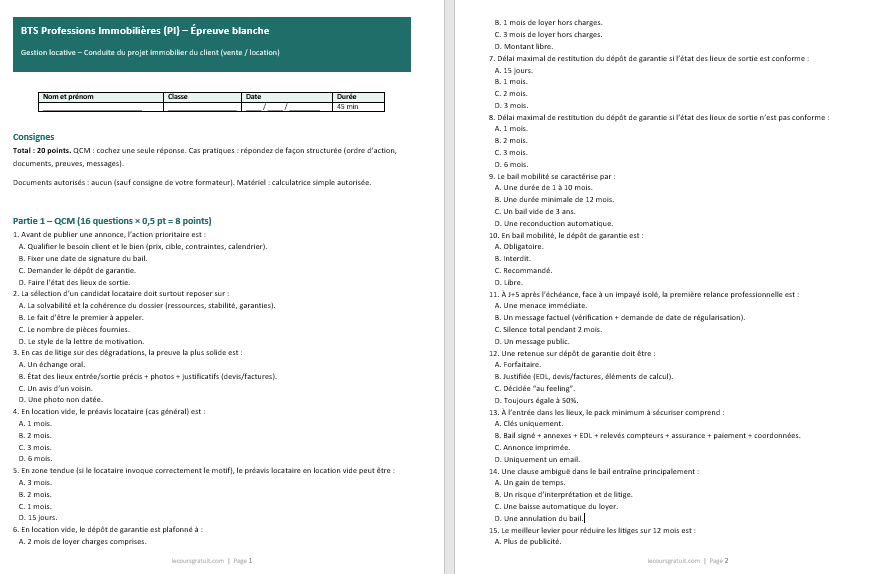
- Titre du QCM : QCM – L’Énergie Interne en Thermodynamique
- Introduction : Présenter brièvement le sujet et les instructions pour répondre au QCM (par exemple, choisir une seule réponse ou plusieurs réponses possibles).
Exemple de questions
Question 1 :
L’énergie interne d’un gaz parfait dépend principalement de :
a) La température du gaz
b) Le volume du gaz
c) La pression du gaz
d) La chaleur du gaz
Réponse correcte : a) La température du gaz
Explication : Pour un gaz parfait, l’énergie interne dépend uniquement de la température, car l’énergie cinétique des molécules est proportionnelle à la température.
Question 2 :
Dans un système fermé, quelle est l’équation correcte de la première loi de la thermodynamique ?
a) ΔU = Q + W
b) ΔU = Q – W
c) ΔU = W – Q
d) ΔU = Q / W
Réponse correcte : b) ΔU = Q – W
Explication : La première loi de la thermodynamique exprime que la variation de l’énergie interne (ΔU) est égale à la différence entre la chaleur apportée au système (Q) et le travail (W) effectué par le système.
Question 3 :
L’énergie interne totale d’un système est la somme de :
a) L’énergie potentielle des particules
b) L’énergie cinétique des particules
c) L’énergie chimique du système
d) Les réponses a) et b)
Réponse correcte : d) Les réponses a) et b)
Explication : L’énergie interne correspond à la somme de l’énergie cinétique et potentielle microscopique des particules du système.
Question 4 :
Si un gaz parfait subit une expansion isotherme (à température constante), l’énergie interne :
a) Augmente
b) Diminue
c) Reste constante
d) Dépend du volume
Réponse correcte : c) Reste constante
Explication : Pour un gaz parfait, l’énergie interne dépend uniquement de la température. Dans une transformation isotherme, la température reste constante, donc l’énergie interne ne change pas.
Question 5 :
L’énergie interne d’un système peut être modifiée en :
a) Ajoutant de la chaleur
b) En faisant du travail sur le système
c) En changeant la pression
d) a) et b) seulement
Réponse correcte : d) a) et b) seulement
Explication : La variation d’énergie interne est influencée par la chaleur ajoutée au système et le travail effectué sur celui-ci, selon la première loi de la thermodynamique.
Étape 4 : Validation du QCM
Relisez les questions pour vous assurer qu’elles sont :
- Claires et précises : Formulez chaque question de manière à éviter toute confusion.
- Équilibrées : Les questions doivent couvrir un éventail large de concepts et de niveaux de difficulté.
- Conformes aux objectifs : Assurez-vous que chaque question évalue bien une compétence ou une connaissance spécifique.
Étape 5 : Correction et explications
Prévoyez une grille de correction avec les réponses et des explications pour chaque réponse correcte. Cela permet aux étudiants de comprendre les erreurs et d’approfondir leur apprentissage.
👉Un QCM bien structuré permet de vérifier la compréhension des notions d’énergie interne et de thermodynamique de manière rapide et efficace. Utilisez ce guide pour couvrir un large éventail de concepts et pour formuler des questions qui mettront au défi les étudiants tout en favorisant leur apprentissage.
Voici un QCM avancé sur l’énergie interne avec des cases à cocher, conçu pour tester une compréhension approfondie des principes de l’énergie interne et de la thermodynamique.
QCM : L’Énergie Interne
Question 1 : Qu’est-ce que l’énergie interne d’un système thermodynamique ?
- [ ] a) L’énergie cinétique totale du système
- [ ] b) L’énergie potentielle due aux forces de gravité
- [ ] c) La somme des énergies cinétique et potentielle microscopiques des particules du système
- [ ] d) L’énergie fournie par une source externe comme le travail ou la chaleur
Question 2 : Parmi les propositions suivantes, lesquelles influencent directement l’énergie interne d’un gaz parfait ?
- [ ] a) La température du gaz
- [ ] b) Le volume du gaz
- [ ] c) La quantité de matière (nombre de moles)
- [ ] d) La pression exercée sur le gaz
Question 3 : Selon la première loi de la thermodynamique (ΔU = Q – W), que représentent Q et W ?
- [ ] a) Q est la chaleur échangée avec l’environnement et W est le travail fourni par le système
- [ ] b) Q est le travail mécanique fourni au système et W est la chaleur dissipée
- [ ] c) Q est l’énergie interne du système et W est la température
- [ ] d) Q est la chaleur interne et W la pression du système
Question 4 : Lors d’une transformation adiabatique réversible (sans échange de chaleur), l’énergie interne d’un gaz parfait dépend de :
- [ ] a) La chaleur ajoutée au système
- [ ] b) Le travail effectué sur le système
- [ ] c) La variation de température
- [ ] d) Le volume du gaz
Question 5 : Si la température d’un gaz parfait augmente, quelle est la conséquence immédiate sur son énergie interne ?
- [ ] a) Elle reste constante
- [ ] b) Elle augmente proportionnellement à la température
- [ ] c) Elle diminue, car le gaz perd de l’énergie
- [ ] d) Elle dépend uniquement du volume et de la pression
Question 6 : Dans quelle situation l’énergie interne d’un système peut-elle diminuer ?
- [ ] a) Lorsque le système effectue du travail sur l’extérieur
- [ ] b) Lorsque de la chaleur est retirée du système
- [ ] c) Lorsque le volume du système diminue à température constante
- [ ] d) Lorsque la température augmente sans variation de volume
Question 7 : Quelles sont les propriétés d’un gaz parfait dans le cadre de l’énergie interne ? (Cochez toutes les bonnes réponses)
- [ ] a) L’énergie interne ne dépend que de la température
- [ ] b) L’énergie interne dépend du volume et de la température
- [ ] c) L’énergie interne est proportionnelle à la pression du gaz
- [ ] d) L’énergie interne ne change pas lors d’une transformation isotherme
Question 8 : Lorsqu’un système fermé reçoit 500 J de chaleur (Q) et effectue un travail (W) de 200 J sur son environnement, quelle est la variation de l’énergie interne (ΔU) du système ?
- [ ] a) 700 J
- [ ] b) 300 J
- [ ] c) 500 J
- [ ] d) 200 J
Question 9 : Lors d’une compression isotherme d’un gaz parfait, quelles sont les conséquences sur le système ? (Cochez toutes les bonnes réponses)
- [ ] a) La température reste constante
- [ ] b) L’énergie interne augmente
- [ ] c) Le travail est fourni sur le système
- [ ] d) Le volume augmente
**Question 10 : Quel énoncé est *faux* concernant l’énergie interne ?**
- [ ] a) L’énergie interne ne dépend pas du type de transformation effectuée (adiabatique, isotherme, etc.)
- [ ] b) L’énergie interne est une fonction d’état
- [ ] c) L’énergie interne d’un gaz parfait ne dépend que de la température
- [ ] d) L’énergie interne d’un système change lorsque du travail est effectué ou que de la chaleur est échangée
Correction des réponses :
- c) La somme des énergies cinétique et potentielle microscopiques des particules du système
- a) La température du gaz, c) La quantité de matière (nombre de moles)
- a) Q est la chaleur échangée avec l’environnement et W est le travail fourni par le système
- b) Le travail effectué sur le système, c) La variation de température
- b) Elle augmente proportionnellement à la température
- a) Lorsque le système effectue du travail sur l’extérieur, b) Lorsque de la chaleur est retirée du système
- a) L’énergie interne ne dépend que de la température, d) L’énergie interne ne change pas lors d’une transformation isotherme
- b) 300 J (ΔU = Q – W, donc ΔU = 500 J – 200 J = 300 J)
- a) La température reste constante, c) Le travail est fourni sur le système
- a) L’énergie interne ne dépend pas du type de transformation effectuée (adiabatique, isotherme, etc.) – ceci est faux, car dans certaines transformations, l’énergie interne peut rester constante (par exemple, dans une transformation isotherme pour un gaz parfait).
Ce QCM énergie interne avancé couvre plusieurs aspects de la thermodynamique, en mettant l’accent sur les concepts liés à la première loi de la thermodynamique, les propriétés des gaz parfaits, et la compréhension des transformations thermodynamiques (adiabatiques, isothermes, etc.).
La chaleur et l’énergie interne sont deux concepts distincts en thermodynamique, mais ils sont souvent liés dans les transformations thermiques. Voici les principales différences entre ces deux notions :
1. Énergie interne
- Définition : L’énergie interne (U) est l’énergie totale contenue dans un système en raison de la somme des énergies microscopiques (énergie cinétique et potentielle) des particules qui le composent. Elle dépend de l’état thermodynamique du système, c’est-à-dire des grandeurs comme la température, le volume et la quantité de matière.
- Nature : C’est une fonction d’état, ce qui signifie que sa valeur dépend uniquement de l’état du système (température, pression, volume, etc.), et non de la manière dont le système a atteint cet état.
- Composantes : Elle comprend principalement :
- L’énergie cinétique microscopique (liée au mouvement des atomes ou molécules).
- L’énergie potentielle microscopique (liée aux interactions entre les particules à l’échelle moléculaire).
- Exemple : Dans un gaz, l’énergie interne est directement liée à la température du gaz, car la température reflète l’agitation des particules (leur énergie cinétique).
2. Chaleur
- Définition : La chaleur (Q) est une forme de transfert d’énergie entre deux systèmes ou entre un système et son environnement en raison d’une différence de température. Elle ne se réfère pas à une énergie contenue dans un système, mais au processus d’échange d’énergie.
- Nature : Contrairement à l’énergie interne, la chaleur n’est pas une fonction d’état. Elle dépend du chemin emprunté par le système pour passer d’un état à un autre. Elle existe seulement quand il y a un transfert d’énergie thermique.
- Direction : La chaleur est toujours transférée du corps le plus chaud vers le corps le plus froid, jusqu’à ce que les deux corps atteignent un équilibre thermique (même température).
- Exemple : Si vous placez un bloc de métal chaud dans un verre d’eau froide, la chaleur est transférée du métal vers l’eau jusqu’à ce que leurs températures s’équilibrent.
Différences clés
| Caractéristique | Énergie Interne | Chaleur |
|---|---|---|
| Définition | Énergie totale contenue dans un système (cinétique + potentielle) | Transfert d’énergie dû à une différence de température |
| Fonction d’état | Oui, c’est une fonction d’état | Non, dépend du processus et du chemin suivi |
| Mesure directe | Dépend de l’état du système (température, quantité de matière, etc.) | Se mesure uniquement lors d’un transfert thermique |
| Processus ou quantité | Quantité d’énergie contenue dans un système | Processus de transfert d’énergie entre systèmes |
| Exemple | L’énergie interne d’un gaz est liée à sa température | Chaleur transférée d’une flamme à une casserole |
Exemple d’interaction entre chaleur et énergie interne :
Supposons que vous chauffiez un gaz contenu dans un récipient :
- Lorsque vous chauffez le gaz, de l’énergie sous forme de chaleur (Q) est transférée dans le système.
- Cette chaleur augmente l’énergie interne (U) du gaz, principalement en augmentant l’agitation (énergie cinétique) des molécules, ce qui se manifeste par une augmentation de la température du gaz.
En résumé :
- L’énergie interne représente l’énergie stockée dans le système, qui dépend de son état.
- La chaleur est une manière de modifier cette énergie interne par échange thermique entre le système et l’environnement.