Fiche de pharmacovigilance —Registre Signalements & délais : prêt à imprimer
Recommandés
Mode d’emploi opérationnel d’un registre “officiel” prêt à imprimer
Un registre de pharmacovigilance sert de mémoire procédurale des signalements, l’outil qui sécurise les délais, et la preuve que chaque cas suit une trajectoire documentée — de la détection à la décision. La fiche A4 “Signalements & délais” fournit un cadre unique pour capter l’information utile, standardiser l’analyse, et piloter la conformité sans surcharge administrative.
1) Finalité du registre : transformer un signal en décision traçable
- Captation : enregistrer immédiatement la détection (T0), la source et les éléments cliniques/produits.
- Qualification : préciser l’effet indésirable, la gravité et la causalité selon un référentiel partagé (ex. catégories OMS-UMC).
- Notification : faire vivre les délais internes et externes, avec des jalons datés et des responsabilités claires.
- Clôture : consigner l’issue, les mesures prises et l’archivage, pour permettre l’analyse rétrospective et l’amélioration continue.
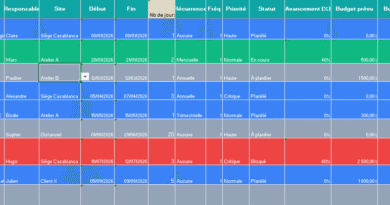
2) Les champs essentiels d’une fiche “allure officielle”
Votre modèle A4 réunit, sur deux pages, la fiche individuelle et le registre de suivi. Les rubriques clés à conserver :
- Identifiants : établissement/service, référence interne du cas (sans données nominatives).
- Signalement : date/heure de détection, source (soignant, patient, pharmacien, autre).
- Patient (pseudonymisé) : initiales/âge/sexe, jamais d’éléments directement identifiants.
- Produit(s) suspect(s) : DCI, spécialité, lot, péremption, indication/posologie/voie.
- Effet(s) indésirable(s) : description factuelle, date/heure de survenue.
- Gravité : critères standard (ex. décès, urgence vitale, hospitalisation, invalidité, etc.).
- Causalité : échelle reconnue (ex. certaine, probable, possible, improbable, non classable).
- Mesures prises : arrêt/réduction dose, traitement symptomatique, surveillance, autres.
- Notifications : interne (date/heure), externe (autorité/centre national), références.
- Délais : détection → notification interne ; validation → envoi externe.
- Validation : responsable PV (nom/signature/date) et statut (brouillon/envoyé/clos).
- Pièces jointes : comptes rendus, examens, documents pharmaceutiques, etc.
3) Gouvernance & rôles
- Responsable PV / Pharmacien responsable : valide la qualification, tranche les notifications externes, surveille les délais et clôture.
- Correspondants cliniques : apportent les éléments médicaux, complètent la description, confirment la gravité/issue.
- Secrétariat/Qualité : contrôle de complétude, suivi documentaire (GED), préparation des audits.
- IT / Data (si SI disponible) : générer des identifiants, sécuriser l’accès, extraire des indicateurs.
4) Les délais : structurer sans ambiguïté
Le registre sert à rendre visibles les délais et à sécuriser l’alerte. À paramétrer selon votre cadre national et vos procédures internes :
- Détection → notification interne : objectif court (ex. heures ouvrées, J0/J1).
- Validation → notification externe : objectif défini par la gravité et les règles locales.
- Boucle de clôture : verrouillage du dossier après obtention des pièces et décisions.
Astuce : imprimez la matrice SLA au verso de la procédure interne pour rappeler, en un coup d’œil, qui fait quoi et sous quel délai (par gravité et par canal).
5) Méthode de priorisation (triage)
- Gravité : traiter en priorité les critères majeurs (urgence vitale, hospitalisation, décès).
- Vulnérabilité : situations à risque (pédiatrie, grossesse, comorbidités, polymédication).
- Signal produit : lot suspect, signaux répétés, classe thérapeutique à vigilance renforcée.
- Incertitude élevée : cas nécessitant une réévaluation rapide (ré-introduction, interactions).
6) Mode d’emploi de la fiche Word (papier “officiel”, usage terrain)
- Ouvrir la fiche individuelle : renseigner T0, la source et le minimum clinique/produit.
- Cocher la gravité et noter la causalité (même provisoire, à confirmer).
- Renseigner les notifications : interne (date/heure) ; externe (si déclenchée, avec réf.).
- Ajouter les pièces : comptes rendus, examens, photos d’étiquetage/lot si pertinents.
- Valider : signature du responsable PV et statut mis à jour (brouillon → envoyé → clos).
- Reporter au registre (page 2) : une ligne par cas, pour le suivi et les indicateurs.
- Archiver : dossier complet en GED ou classeur dédié, avec index et durée de conservation.
7) Indicateurs & tableaux de bord (suivi mensuel/trim.)
Des KPIs simples et robustes suffisent à piloter la conformité :
- Délai médian détection → notif. interne.
- % de notifications internes sous SLA.
- % de notifications externes réalisées dans le bon délai, par gravité.
- Taux de dossiers complets à la clôture.
- Temps moyen de clôture (ou médian si distribution asymétrique).
- Taux de ré-ouverture (dossiers nécessitant compléments).
Exemples de calculs (Excel – fonctions FR) :
DÉLAI_JOURS = Date_Envoi - Date_Détection
%_Sous_SLA_Interne = NB.SI.ENS(Registre[Delai_Interne];"<="&SLA_Interne) / NB(Registre[Delai_Interne])
%_Externes_Conformes = NB.SI.ENS(Registre[Notif_Externe];"Oui";Registre[Delai_Externe];"<="&SLA_Externe)
/ NB.SI(Registre[Notif_Externe];"Oui")
Conseil : conservez un champ “Statut” (Brouillon/Envoyé/Clos) et un champ “Actions” pour noter les mesures correctives (arrêt, réduction dose, DMOS, rappel interne, etc.).
8) Qualité, confidentialité & auditabilité
- Pseudonymisation stricte : initiales/âge/sexe ; jamais d’identifiants directs.
- Minimisation des données : seules les informations utiles à la qualification.
- Traçabilité : dates/heures, signataire, références d’envoi, version des pièces.
- Conservation maîtrisée : durée définie par votre politique documentaire ; registre indexé.
- Revue périodique : échantillonnage de dossiers pour vérifier complétude, délais, cohérence gravité/causalité.
9) Papier, SI & passerelles (QR/Code-128)
La fiche Word A4 reste l’outil le plus universel pour les sites sans SI dédié ou en mobilité. Pour relier papier et numérique :
- Code-barres / QR interne : encoder l’ID du dossier ; à la saisie, un scan ouvre la fiche correspondante dans la GED.
- Tampon dateur sur T0 et sur l’envoi externe.
- Index d’archivage : numéroter les dossiers (année-séquence) et lier au registre.
10) Bonnes pratiques & pièges à éviter
- Écrire factuellement : décrire l’effet indésirable sans interprétation hâtive.
- Renseigner tous les jalons (T0, validation, envoi) pour objectiver les délais.
- Utiliser une terminologie standard pour les effets (homogénéité d’analyse).
- Ne pas “tarder pour compléter” : initier le dossier, marquer “incomplet”, puis mettre à jour.
- Toujours signer/valider : un signal non validé n’existe pas sur le plan qualité.
11) Procédure minimale (exemple à adapter)
But : enregistrer, qualifier, notifier, clôturer.
Portée : tout effet indésirable suspecté lié à un médicament ou produit pertinent.
- Détection (T0) — Tout professionnel : ouvrir la fiche, remplir rubriques mini, informer le référent.
- Triage gravité — Référent clinique + Responsable PV : classer, décider du canal d’alerte.
- Causalité provisoire — Responsable PV : première estimation, demander pièces manquantes.
- Notification interne — Dans le SLA : datée/horodatée dans la fiche.
- Notification externe — Si requise selon la gravité/contexte : consigner date/référence d’envoi.
- Mesures — Clinique/Pharmacie : documenter (arrêt/réduction dose/traitement).
- Clôture — Responsable PV : statut “Clos”, pièces rassemblées, archivage.
- Revue mensuelle — PV/Qualité : extraction des KPIs, plan d’actions si dérives.
12) Check-list de contrôle de dossier (à glisser en annexe)
- Référence interne présente et cohérente avec le registre.
- T0 et source du signalement renseignés.
- Produit(s) suspect(s) + lot/péremption saisis.
- Description de l’effet + date/heure de survenue.
- Gravité cochée, causalité renseignée (même provisoire).
- Notification interne datée ; notification externe si applicable (date + réf.).
- Mesures prises notées ; issue/évolution renseignée.
- Signature/validation responsable PV.
- Pièces jointes listées.
- Statut “Clos” et dossier archivé.
Un bon registre rend les délais visibles, fiabilise la notification et protège l’établissement. La fiche A4 “Signalements & délais” harmonise la saisie, facilite la validation, et fait gagner du temps lors des audits. Imprimée au poste de soins ou intégrée à la GED via un QR interne, elle devient le pivot entre terrain, pharmacovigilance et qualité.


mini-formules prêtes à l’emploi (dans votre tableau de registre)
Délais_Interne (jours) = [Notif_Interne] - [T0]
Délais_Externe (jours) = [Envoi_Externe] - [Validation]
SLA_OK_Interne = SI([Délais_Interne] <= [SLA_Interne]; "Oui"; "Non")
SLA_OK_Externe = SI(ET([Notif_Externe]="Oui"; [Délais_Externe] <= [SLA_Externe]); "Oui"; "Non")
Encadré réglementaire — Pharmacovigilance (à intégrer à la fiche)
Objet. Ce registre sert à documenter, tracer et rapporter tout effet indésirable (EI) suspecté lié à un médicament ou produit assimilé. Il complète la procédure interne de pharmacovigilance et ne remplace pas les notifications légales à l’autorité compétente.
Champ d’application.
S’applique à tout EI suspecté (grave ou non grave), attendu ou non attendu, survenu dans l’établissement ou signalé par un tiers (patient, professionnel de santé, pharmacien), y compris après sortie et cas relevés a posteriori.
Principes de conformité.
- Détection → Qualification → Notification → Clôture : chaîne ininterrompue, avec jalons datés/horodatés.
- Gravité & causalité : utiliser des critères standardisés (ex. CIOMS/ICH, échelle OMS-UMC) et une terminologie harmonisée (ex. MedDRA).
- Minimisation des données : interdiction d’identifier directement la personne (pseudonymisation).
- Traçabilité : toute décision (notifier / ne pas notifier, mesures, clôture) est justifiée et signée.
Rôles & responsabilités.
- Responsable PV / Pharmacien responsable : qualification finale, décision de notification externe, validation et clôture.
- Référent(s) clinique(s) : apport d’éléments médicaux, confirmation de la gravité/issue.
- Qualité / Documentaliste : contrôle de complétude, indexation, préparation audit.
- IT / Data (le cas échéant) : sécurisation des accès, traçabilité des versions, extractions KPI.
Délais (à paramétrer selon votre pays et votre procédure).
- Notification interne : dès la détection (J0/J1) avec alerte au responsable PV.
- Notification externe : selon la gravité, la nature de l’EI et les règles nationales applicables.
- Clôture : après obtention des pièces et confirmation de l’issue, dans un délai maîtrisé.
Traçabilité & conservation.
- Enregistrer : T0 (détection), validations, envois externes (dates/références), statut (Brouillon/Envoyé/Clos).
- Conserver : registre et pièces justificatives selon la politique documentaire et les exigences nationales (durée à définir par l’établissement).
- Assurer : versionnage, index, plan d’archivage et réversibilité.
Protection des données.
- Pseudonymisation stricte (initiales/âge/sexe, identifiant interne).
- Accès restreints au besoin-d’en-connaître ; traçabilité des consultations.
- Sensibilisation du personnel aux règles de confidentialité et aux violations potentielles.
Audits & amélioration continue.
- Revue périodique des dossiers (échantillonnage).
- Indicateurs : délais internes/externes, conformité SLA, complétude à la clôture, ré-ouvertures.
- Plan d’actions en cas d’écarts récurrents.
Repères d’autorités compétentes (adapter la terminologie locale).
- France : autorités sanitaires nationales (ex. ANSM) via réseau de pharmacovigilance.
- Maroc : Centre Anti-Poison et de Pharmacovigilance du Maroc (CAPM) / dispositifs nationaux.
- Suisse : Swissmedic / réseau de PV.
- Canada : Santé Canada / programmes de vigilance.
Vérifier et intégrer les formulaires, canaux et délais en vigueur pour votre site.
Cas particuliers.
- Séries/cluster (même lot ou même produit) : alerte immédiate au responsable PV, évaluation renforcée.
- Grossesse, pédiatrie, comorbidités majeures : triage prioritaire, documentation clinique accrue.
- Ré-exposition / interactions : réévaluation causale rapide, décision de mesure conservatoire.
Clause d’usage.
Cet encadré constitue un aide-mémoire opérationnel. Il doit être annexé à la procédure interne de pharmacovigilance de l’établissement, laquelle prévaut en cas de divergence. Aucune mention nominative n’est autorisée sur le registre.