Bilan de Matière d’une Réaction Chimique : Méthodologie et Applications
Recommandés
En génie des procédés et en chimie industrielle, le bilan de matière est une étape cruciale pour concevoir, optimiser, et contrôler les procédés de production. Il permet de quantifier les flux de matière entrant et sortant d’un système afin d’assurer l’efficacité et la rentabilité du procédé. Cet article propose une approche méthodologique pour réaliser un bilan de matière autour d’une réaction chimique en présentant les principes fondamentaux, la formulation des bilans pour des systèmes variés, et des exemples d’application.
1. Principes du Bilan de Matière
Le bilan de matière repose sur un principe simple : la conservation de la masse. Cela signifie que, dans un système fermé, la masse totale des réactifs entrant doit être égale à la masse des produits et des sous-produits sortants, en tenant compte des accumulations potentielles à l’intérieur du système. Dans une réaction chimique, ce principe implique également que la quantité de chaque élément chimique doit être conservée, ce qui permet de relier précisément les quantités des réactifs et des produits en fonction des coefficients stœchiométriques de la réaction.
L’équation de base pour un bilan de matière peut être exprimée comme suit :
Entrée – Sortie + Production – Consommation = Accumulation
Pour un processus en régime stationnaire (sans accumulation), l’équation se simplifie à :
Entrée = Sortie
Dans le cas d’une réaction chimique, les termes de Production et Consommation représentent respectivement la formation de produits et la consommation de réactifs.
2. Étapes pour Réaliser un Bilan de Matière
La réalisation d’un bilan de matière se déroule en plusieurs étapes :
Étape 1 : Définir les Frontières du Système
Identifiez les limites du système étudié. Il peut s’agir d’un réacteur, d’une unité de séparation, d’une section de production, ou de l’ensemble d’un procédé.
Étape 2 : Choisir une Base de Calcul
La base de calcul correspond généralement à une quantité de réactif, de produit ou un débit massique/volumique. Cette base permet de simplifier les calculs et de normaliser les résultats (ex. : 1 mol de réactif ou 1 heure de fonctionnement).
Étape 3 : Écrire l’Équation de Réaction et Identifier les Flux
- Équation de réaction : Notez l’équation stœchiométrique qui décrit la transformation des réactifs en produits.
- Débits de matière : Identifiez les quantités de réactifs et de produits en termes de débit massique, volumique, ou molaire.
Étape 4 : Appliquer le Principe de Conservation
Formulez les bilans de matière pour chaque composant de l’équation chimique. Pour chaque espèce chimique, écrivez une équation de bilan basée sur la quantité de matière avant et après la réaction.
Étape 5 : Résoudre les Équations
Utilisez les données d’entrée pour résoudre le système d’équations et obtenir les débits de sortie ou les quantités produites pour chaque espèce chimique.
3. Exemples de Bilan de Matière : Réaction de Synthèse de l’Ammoniac
Considérons la synthèse de l’ammoniac, une réaction industrielle classique, où l’azote N_2 réagit avec l’hydrogène H_2 pour former de l’ammoniac NH_3 selon l’équation suivante :
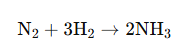
Supposons que 100 mol d’azote et 300 mol d’hydrogène entrent dans le réacteur. Le bilan de matière permettra de déterminer la quantité d’ammoniac produite et les quantités de réactifs non consommés en fonction du rendement de la réaction.
3.1 Calcul de la Production
- Si la réaction est complète, l’azote serait le réactif limitant.
- Nombre de moles d’ammoniac produites = 200 mol
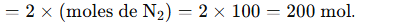
3.2 Si la Conversion n’est pas Totale
Si la conversion de N_2 est de 90 %, la quantité d’azote réagie sera :
100 mol × 0,9= 90mol
L’hydrogène consommé sera alors 3 x 90 = 270 mol, et la production d’ammoniac sera ( 2 \times 90 = 180 \, \text{mol}).
4. Applications et Intérêts du Bilan de Matière
Optimisation des Procédés
Les bilans de matière permettent d’identifier les réactifs en excès, d’optimiser les conditions opératoires, et de réduire les coûts des matières premières.
Réduction des Déchets
Ils aident à minimiser les déchets en ajustant les quantités de réactifs et les conditions de réaction pour maximiser le rendement.
Impact Environnemental
Les bilans de matière sont essentiels pour calculer les émissions potentielles et évaluer les impacts environnementaux des procédés industriels
👉 Le bilan de matière est un outil indispensable en chimie et en génie des procédés, permettant de contrôler les flux de matières et d’assurer le bon fonctionnement des réactions chimiques. Ce bilan est donc non seulement une base pour la conception et l’optimisation des procédés mais également un levier d’innovation pour une industrie chimique plus durable.
Une méthodologie rigoureuse et à une analyse détaillée des flux permet aux ingénieurs optimiser les processus industriels et réduire les coûts et les impacts environnementaux.
Voici plusieurs exemples concrets de bilans de matière en génie des procédés, illustrant différentes situations couramment rencontrées dans l’industrie chimique, alimentaire ou pharmaceutique. Chaque exemple suit une méthode similaire : définition du système, identification des réactifs et produits, et application du principe de conservation de la matière.
Voici la version améliorée, incluant une courte introduction textuelle pour chaque exemple de bilan de matière :
Exemple 1 : Synthèse de l’Ammoniac
Dans cet exemple, nous analysons la synthèse de l’ammoniac, un procédé clé dans l’industrie chimique, où l’azote ( \text{N}_2 ) réagit avec l’hydrogène ( \text{H}_2 ) pour former de l’ammoniac ( \text{NH}_3 ). Le but du bilan est de calculer les quantités de réactifs consommés, de produit formé, et des réactifs restants en sortie.
reaction:
- equation: "N2 + 3 H2 -> 2 NH3"
data:
- N2_in: 100 mol/h
- H2_in: 300 mol/h
- conversion_N2: 90%
calculations:
- N2_consumed: "N2_in * conversion_N2" # 100 * 0.9 = 90 mol/h
- H2_consumed: "3 * N2_consumed" # 3 * 90 = 270 mol/h
- NH3_produced: "2 * N2_consumed" # 2 * 90 = 180 mol/h
results:
- N2_remaining: "N2_in - N2_consumed" # 100 - 90 = 10 mol/h
- H2_remaining: "H2_in - H2_consumed" # 300 - 270 = 30 mol/hExemple 2 : Réaction d’Estérification
Ici, nous étudions une réaction d’estérification, dans laquelle un acide carboxylique ( \text{R-COOH} ) réagit avec un alcool ( \text{R’-OH} ) pour produire un ester ( \text{R-COOR’} ) et de l’eau. Le bilan vise à déterminer les quantités des réactifs consommés et des produits formés en fonction de la conversion.
reaction:
- equation: "R-COOH + R'-OH -> R-COOR' + H2O"
data:
- R_COOH_in: 50 mol/h
- R_OH_in: 60 mol/h
- conversion_R_COOH: 80%
calculations:
- R_COOH_consumed: "R_COOH_in * conversion_R_COOH" # 50 * 0.8 = 40 mol/h
- R_OH_consumed: "R_COOH_consumed" # 1:1 ratio, so 40 mol/h
- ester_produced: "R_COOH_consumed" # 40 mol/h
- H2O_produced: "R_COOH_consumed" # 40 mol/h
results:
- R_COOH_remaining: "R_COOH_in - R_COOH_consumed" # 50 - 40 = 10 mol/h
- R_OH_remaining: "R_OH_in - R_OH_consumed" # 60 - 40 = 20 mol/hExemple 3 : Fermentation pour la Production d’Éthanol
Dans cet exemple, nous examinons un processus de fermentation où le glucose ( \text{C}6\text{H}{12}\text{O}_6 ) est converti en éthanol ( \text{C}_2\text{H}_5\text{OH} ) et en dioxyde de carbone ( \text{CO}_2 ). Ce bilan permet de calculer les quantités de glucose consommé, d’éthanol et de dioxyde de carbone produits.
reaction:
- equation: "C6H12O6 -> 2 C2H5OH + 2 CO2"
data:
- glucose_in: 100 kg/h
- molar_mass_glucose: 180 g/mol
- conversion_glucose: 90%
calculations:
- moles_glucose_in: "glucose_in * 1000 / molar_mass_glucose" # (100 * 1000) / 180 ≈ 555.56 mol/h
- glucose_consumed: "moles_glucose_in * conversion_glucose" # 555.56 * 0.9 = 500 mol/h
- ethanol_produced: "2 * glucose_consumed" # 2 * 500 = 1000 mol/h
- CO2_produced: "2 * glucose_consumed" # 2 * 500 = 1000 mol/h
results:
- glucose_remaining: "moles_glucose_in - glucose_consumed" # 555.56 - 500 = 55.56 mol/hExemple 4 : Distillation d’un Mélange Binaire
Dans ce dernier exemple, nous analysons une colonne de distillation qui sépare un mélange binaire d’eau et d’éthanol. Le bilan de matière nous aide à déterminer les flux massiques dans le distillat (produit en tête) et dans le résidu (bas de colonne).
process:
- operation: "Distillation of water-ethanol mixture"
data:
- feed_rate: 1000 kg/h
- ethanol_feed_fraction: 30% # 0.3 in mass
- ethanol_recovery: 90%
- ethanol_fraction_distillate: 85% # 0.85 in mass
calculations:
- ethanol_in_feed: "feed_rate * ethanol_feed_fraction" # 1000 * 0.3 = 300 kg/h
- ethanol_in_distillate: "ethanol_in_feed * ethanol_recovery" # 300 * 0.9 = 270 kg/h
- distillate_rate: "ethanol_in_distillate / ethanol_fraction_distillate" # 270 / 0.85 ≈ 317.65 kg/h
- water_in_distillate: "distillate_rate - ethanol_in_distillate" # 317.65 - 270 = 47.65 kg/h
- bottoms_rate: "feed_rate - distillate_rate" # 1000 - 317.65 ≈ 682.35 kg/h
results:
- ethanol_distillate: "270 kg/h"
- water_distillate: "47.65 kg/h"
- distillate_rate: "317.65 kg/h"
- bottoms_rate: "682.35 kg/h"Ces descriptions fournissent une compréhension de chaque bilan de matière avec le contexte, les données, et les calculs nécessaires clair et structuré.
Voici les exercices complétés avec des descriptions plus détaillées et des calculs intermédiaires supplémentaires là où nécessaire.
Exercice 1 : Réaction de Synthèse de l’Ammoniac
Énoncé : L’azote ( \text{N}_2 ) réagit avec l’hydrogène ( \text{H}_2 ) pour produire de l’ammoniac ( \text{NH}_3 ). Les débits d’entrée sont de 200 mol/h pour ( \text{N}_2 ) et de 600 mol/h pour ( \text{H}_2 ). Le rendement de la conversion de ( \text{N}_2 ) est de 80 %. Calculez la quantité de ( \text{NH}_3 ) produite ainsi que les quantités de ( \text{N}_2 ) et ( \text{H}_2 ) restantes.
reaction:
- equation: "N2 + 3 H2 -> 2 NH3"
data:
- N2_in: 200 mol/h
- H2_in: 600 mol/h
- conversion_N2: 80%
calculations:
- N2_consumed: "N2_in * conversion_N2" # 200 * 0.8 = 160 mol/h
- H2_consumed: "3 * N2_consumed" # 3 * 160 = 480 mol/h
- NH3_produced: "2 * N2_consumed" # 2 * 160 = 320 mol/h
results:
- N2_remaining: "N2_in - N2_consumed" # 200 - 160 = 40 mol/h
- H2_remaining: "H2_in - H2_consumed" # 600 - 480 = 120 mol/h
solution:
- description: |
La quantité de \( \text{NH}_3 \) produite est calculée en fonction de la consommation de \( \text{N}_2 \),
car l'azote est le réactif limitant. On en déduit les réactifs restants en sortie.
- N2_remaining: 40 mol/h
- H2_remaining: 120 mol/h
- NH3_produced: 320 mol/hExercice 2 : Oxydation du Glucose
Énoncé : Lors de l’oxydation complète du glucose ( \text{C}6\text{H}{12}\text{O}_6 ), celui-ci réagit avec de l’oxygène ( \text{O}_2 ) pour produire du dioxyde de carbone ( \text{CO}_2 ) et de l’eau ( \text{H}_2\text{O} ). Si 180 g de glucose (1 mole) réagissent avec un excès d’oxygène, calculez la quantité de ( \text{CO}_2 ) et ( \text{H}_2\text{O} ) produite.
reaction:
- equation: "C6H12O6 + 6 O2 -> 6 CO2 + 6 H2O"
data:
- glucose_in: 180 g
- molar_mass_glucose: 180 g/mol
- conversion: 100%
calculations:
- moles_glucose: "glucose_in / molar_mass_glucose" # 180 / 180 = 1 mol
- CO2_produced: "6 * moles_glucose" # 6 * 1 = 6 mol
- H2O_produced: "6 * moles_glucose" # 6 * 1 = 6 mol
results:
- CO2_produced_moles: 6 mol
- H2O_produced_moles: 6 mol
solution:
- description: |
Le glucose est totalement oxydé en \( \text{CO}_2 \) et \( \text{H}_2\text{O} \).
On utilise les coefficients stœchiométriques pour déterminer les produits formés.
- CO2_produced_moles: 6 mol
- H2O_produced_moles: 6 molExercice 3 : Production d’Éthanol par Fermentation
Énoncé : Dans un réacteur de fermentation, du glucose ( \text{C}6\text{H}{12}\text{O}_6 ) est converti en éthanol ( \text{C}_2\text{H}_5\text{OH} ) et en dioxyde de carbone ( \text{CO}_2 ) avec un rendement de 85 %. Si on introduit 540 g de glucose, calculez les quantités d’éthanol et de ( \text{CO}_2 ) produites.
reaction:
- equation: "C6H12O6 -> 2 C2H5OH + 2 CO2"
data:
- glucose_in: 540 g
- molar_mass_glucose: 180 g/mol
- conversion_glucose: 85%
calculations:
- moles_glucose_in: "glucose_in / molar_mass_glucose" # 540 / 180 = 3 mol
- glucose_consumed: "moles_glucose_in * conversion_glucose" # 3 * 0.85 = 2.55 mol
- ethanol_produced: "2 * glucose_consumed" # 2 * 2.55 = 5.1 mol
- CO2_produced: "2 * glucose_consumed" # 2 * 2.55 = 5.1 mol
results:
- ethanol_produced_moles: 5.1 mol
- CO2_produced_moles: 5.1 mol
solution:
- description: |
Le rendement étant de 85 %, seule une partie du glucose est convertie en éthanol et \( \text{CO}_2 \).
Le calcul des produits suit les coefficients de la réaction stœchiométrique.
- ethanol_produced_moles: 5.1 mol
- CO2_produced_moles: 5.1 molExercice 4 : Distillation d’un Mélange d’Éthanol et d’Eau
Énoncé : Une colonne de distillation traite un mélange binaire d’eau et d’éthanol avec un débit d’alimentation de 2000 kg/h contenant 40 % en masse d’éthanol. Si 85 % de l’éthanol est récupéré dans le distillat avec une pureté de 90 % en masse, calculez les débits massiques du distillat et du résidu (bas de colonne).
process:
- operation: "Distillation of ethanol-water mixture"
data:
- feed_rate: 2000 kg/h
- ethanol_feed_fraction: 40% # 0.4 in mass
- ethanol_recovery: 85%
- ethanol_fraction_distillate: 90% # 0.9 in mass
calculations:
- ethanol_in_feed: "feed_rate * ethanol_feed_fraction" # 2000 * 0.4 = 800 kg/h
- ethanol_in_distillate: "ethanol_in_feed * ethanol_recovery" # 800 * 0.85 = 680 kg/h
- distillate_rate: "ethanol_in_distillate / ethanol_fraction_distillate" # 680 / 0.9 ≈ 755.56 kg/h
- water_in_distillate: "distillate_rate - ethanol_in_distillate" # 755.56 - 680 = 75.56 kg/h
- bottoms_rate: "feed_rate - distillate_rate" # 2000 - 755.56 ≈ 1244.44 kg/h
results:
- distillate_rate: 755.56 kg/h
- ethanol_distillate: 680 kg/h
- water_distillate: 75.56 kg/h
- bottoms_rate: 1244.44 kg/h
solution:
- description: |
Le bilan de matière utilise la fraction d'éthanol récupéré et sa pureté dans le distillat
pour déterminer les flux massiques en sortie de la colonne de distillation.
- distillate_rate: 755.56 kg/h
- bottoms_rate: 1244.44 kg/hVoici la suite et la fin de l’exercice 5 complété :
Exercice 5 : Neutralisation d’un Acide par une Base
Énoncé : Lors de la neutralisation de l’acide chlorhydrique ( \text{HCl} ) par de l’hydroxyde de sodium ( \text{NaOH} ), on obtient du chlorure de sodium ( \text{NaCl} ) et de l’eau ( \text{H}_2\text{O} ). Si 0,5 mole de ( \text{HCl} ) est mélangée avec 0,3 mole de ( \text{NaOH} ), déterminez la quantité de ( \text{NaCl} ) produite ainsi que les réactifs restants.
reaction:
- equation: "HCl + NaOH -> NaCl + H2O"
data:
- HCl_in: 0.5 mol
- NaOH_in: 0.3 mol
calculations:
- NaCl_produced: "min(HCl_in, NaOH_in)" # 0.3 mol, limité par NaOH
- HCl_remaining: "HCl_in - NaCl_produced" # 0.5 - 0.3 = 0.2 mol
- NaOH_remaining: "NaOH_in - NaCl_produced" # 0.3 - 0.3 = 0 mol
results:
- NaCl_produced: 0.3 mol
- HCl_remaining: 0.2 mol
- NaOH_remaining: 0 mol
solution:
- description: |
Dans cette réaction de neutralisation, le \( \text{NaOH} \) est le réactif limitant, car sa quantité
est insuffisante pour réagir avec tout le \( \text{HCl} \). En conséquence, 0,3 mole de \( \text{NaCl} \) est produite,
et il reste 0,2 mole de \( \text{HCl} \) non réagi.
- NaCl_produced: 0.3 mol
- HCl_remaining: 0.2 mol
- NaOH_remaining: 0 molCes exercices fournissent des exemples concrets de bilans de matière pour divers types de réactions et procédés. Chaque exercice inclut une description des données, des calculs détaillés, et les résultats finaux, permettant une compréhension complète de chaque situation.