ISO 14971 en pratique : conduire l’analyse de risques d’un dispositif médical avec AMDEC et checklist de conformité
Recommandés
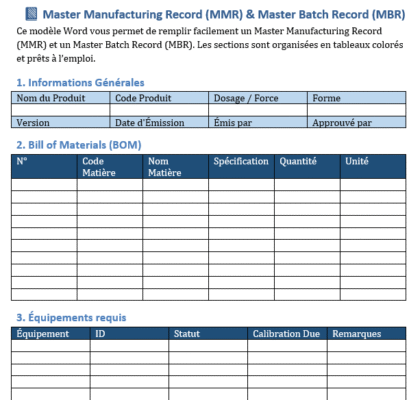
Télécharger un modèle Excel checklist de conformité ISO 14971 + l’analyse de risques d’un dispositif médical avec AMDEC
L’analyse de risques n’est pas un simple document supplémentaire, elle constitue la colonne vertébrale assurant la sûreté d’utilisation d’un dispositif médical. La norme ISO 14971 structure cette démarche de bout en bout, de la définition de l’usage prévu jusqu’au suivi post-commercialisation. Le présent guide a pour objectif d’aider à déployer la procédure en articulant l’AMDEC médicale et la gestion des risques selon l’ISO 14971, et en sécurisant la conformité au moyen d’une checklist claire. La complexité de l’analyse requiert rigueur et méthodologie afin d’anticiper et maîtriser les risques potentiels portés par un dispositif.
1) Cadre et objectifs
- But : identifier les dangers, évaluer les risques, mettre en œuvre des maîtrises efficaces, juger l’acceptabilité du risque résiduel et maintenir la sécurité tout au long du cycle de vie.
- Périmètre : produit, accessoire, logiciel embarqué/standalone, interface utilisateur, fabrication, maintenance, transport, stockage, réutilisation.
- Livrable central : dossier de gestion des risques (Risk Management File, RMF) qui relie exigences, analyses, vérifications et décisions.
2) La procédure ISO 14971 étape par étape
- Plan de gestion des risques : rôles, méthodes, échelles d’évaluation, critères d’acceptation, règles de traçabilité.
- Analyse des risques : usage prévu et mésusages raisonnablement prévisibles, caractéristiques liées à la sécurité, dangers → situations dangereuses → séquences d’événements → atteintes.
- Évaluation : estimation de la sévérité et de la probabilité d’occurrence du dommage (nuance importante vs taux de défaillance).
- Maîtrise : hiérarchie des options – sécurité intrinsèque d’abord, puis protections, puis information/formation.
- Vérification d’efficacité : la maîtrise est-elle bien implémentée et suffisante ?
- Risque résiduel et bilan bénéfice/risque : décision d’acceptabilité selon la politique définie.
- Production & post-production : collecte des retours, vigilance, tendances, CAPA, mise à jour continue du RMF.
3) Où et comment l’AMDEC s’insère
L’AMDEC (FMEA) est une technique utile dans l’étape d’analyse, surtout pour le design (DFMEA) et la fabrication (PFMEA). Elle structure par Mode de défaillance → Causes → Effets avec trois notations :
- S (Sévérité), O (Occurrence), D (Détectabilité), souvent 1–5.
- RPN = S×O×D pour hiérarchiser les actions.
Points d’alignement avec ISO 14971 :
- L’ISO 14971 raisonne en sévérité × probabilité d’atteinte ; la détectabilité peut aider à estimer la probabilité, mais ne remplace pas l’analyse « danger → atteinte ».
- Ne pas se reposer uniquement sur le RPN : une sévérité élevée peut justifier une action même si l’occurrence est faible.
- Faire le pont : reliez chaque mode de défaillance à un danger/situation dangereuse/atteinte, et référencez vos exigences, tests et preuves.
4) Construire des échelles et critères robustes
- Échelles : S et O sur 1–5 avec définitions verbales et exemples (cliniques, usage, environnement).
- Politique d’acceptation : par exemple « Faible = Acceptable », « Moyen = ALARP », « Haut = Non acceptable ». Documentez les exceptions et la gouvernance d’arbitrage.
- Seuils d’alerte : RPN (si utilisé), niveaux S×O, risques critiques à sévérité élevée indépendamment du RPN.
5) Maîtrise des risques : la bonne hiérarchie
- Sécurité intrinsèque : supprimer/réduire le danger par conception (limitation d’énergie, matériaux, architecture).
- Mesures de protection : protections matérielles/logiciels, interverrouillages, détections, alarmes.
- Information pour la sécurité : étiquetage, IFU, formation.
Chaque mesure doit être spécifiée, vérifiée (implémentation) puis validée (efficacité). Documentez résiduel et justification bénéfice/risque.
6) Traçabilité et preuves
- Donnez des ID uniques aux dangers, situations, modes de défaillance, actions.
- Reliez à REQ (exigences), TST (rapports d’essais), V&V, CAPA, changement (ECO).
- Maintenez une chaîne de traçabilité « risque ↔ exigences ↔ tests ↔ décision ».
7) Checklist de conformité (synthèse utile)
- Clause 4 : processus, compétences, RMF vivant.
- Clause 5 : analyse structurée, mésusages prévisibles, UI/ergonomie considérées.
- Clause 6 : critères d’acceptation définis à l’avance.
- Clause 7 : maîtrise avec hiérarchie, vérif d’implémentation et d’efficacité.
- Clause 8 : évaluation du risque résiduel global (pas seulement item par item).
- Clause 9 : revue RMF avant libération, décisions consignées.
- Clause 10 : surveillance post-market, données terrain, mise à jour RMF.
8) Indicateurs qui aident réellement
- % d’actions de maîtrise à l’échéance,
- de risques « Haut » non clôturés,
- Délai moyen détection → correction (boucle CAPA),
- Tendances post-market (taux d’incidents pondérés par gravité).
9) Pièges fréquents et parades
- RPN-isme : n’ignorez jamais une sévérité élevée sous prétexte d’un RPN « acceptable ».
- Détectabilité mal comprise : ne confondez pas D avec la probabilité d’atteinte.
- Maîtrises non vérifiées : exigez des preuves d’efficacité, pas seulement d’implémentation.
- RMF statique : raccordez-le au post-market et aux changements de design.
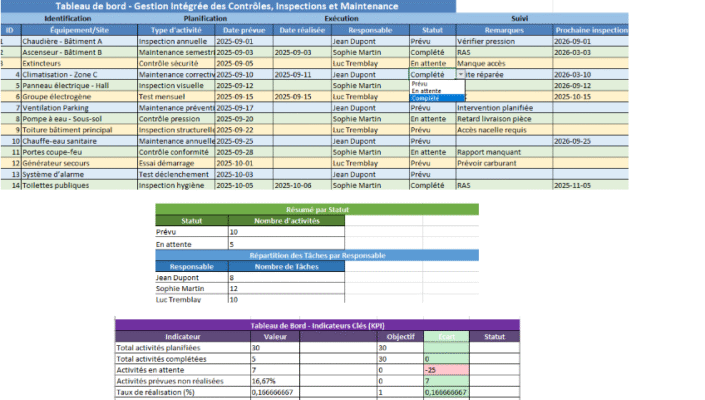
10) Mettre l’outil Excel au service du processus
Le classeur fourni « ISO14971_AMDEC_Checklist_FR_v2.xlsx » vous fait gagner du temps :
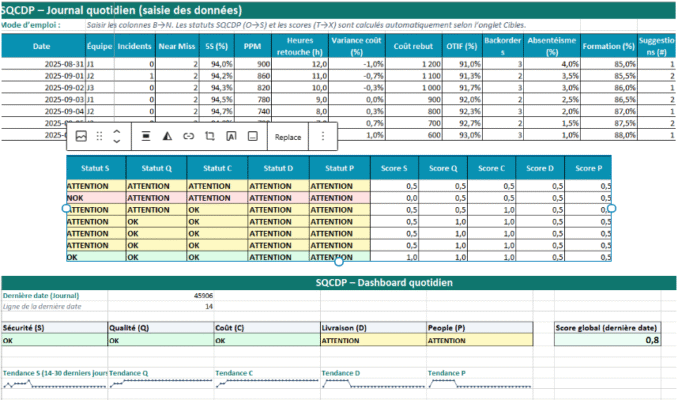
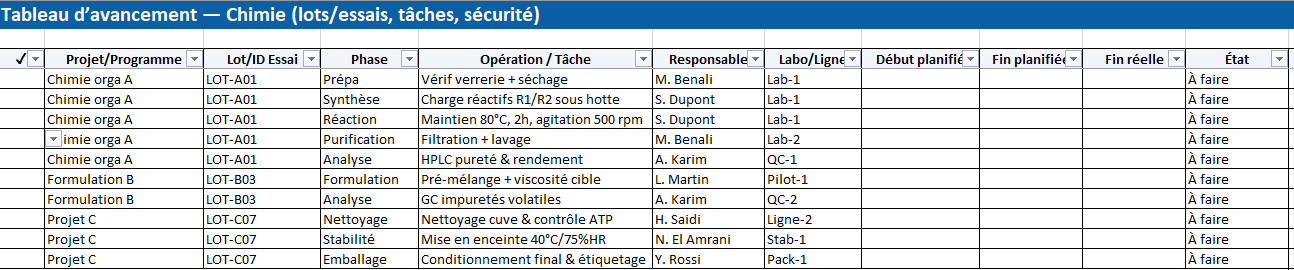
- AMDEC : calcul automatique RPN, niveaux par matrice S×O, listes déroulantes d’options de maîtrise, suivi statut/échéance.
- Analyse des risques ISO 14971 : modèle « danger → situation → séquence → atteinte » avec niveaux initial/résiduel automatiques.
- Checklist conformité : clauses 4→10 pré-remplies pour piloter les preuves.
- Paramètres : ajustez échelles et seuils sans toucher aux formules.
11) Démarrage rapide de votre projet
- Rédigez le Plan de gestion des risques (échelles, critères, rôles).
- Lancez l’Analyse : renseignez les lignes « Risques » et, en parallèle, les AMDEC de design/process.
- Décidez des maîtrises, planifiez les actions, liez les preuves.
- Évaluez le résiduel et le bénéfice/risque global.
- Organisez la revue et passez en post-market avec un circuit CAPA réactif.
Modèle mise en œuvre de ISO 14971 — AMDEC médicale & Checklist de conformité
Description claire, structurée et pratico-pratique
1) À quoi sert ce fichier ?
Ce classeur a un but simple : rendre l’analyse de risques ISO 14971 opérationnelle — depuis l’identification des dangers jusqu’au suivi des actions — tout en gardant une traçabilité propre et prête pour l’audit. Il combine la rigueur d’ISO 14971 (analyse des risques, acceptabilité, post-market) et la puissance d’une AMDEC médicale pour prioriser et traiter les modes de défaillance.
2) La carte du classeur (les onglets, et leur rôle)
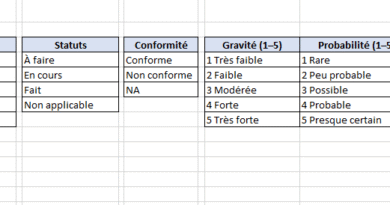
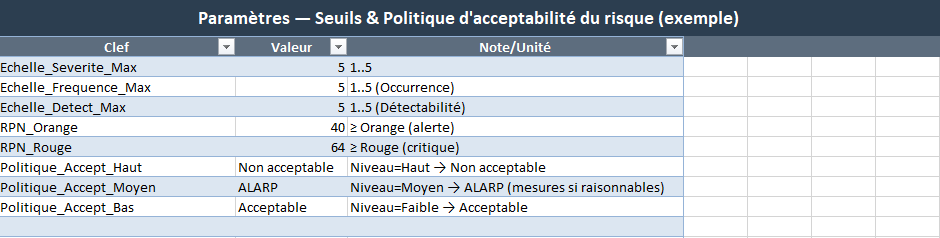
Parametres
- Rôle : centraliser les seuils et la politique d’acceptabilité (ex. seuils RPN « Orange », « Rouge » ; règles d’interprétation Faible/Moyen/Haut).
- Vous remplissez : les valeurs et commentaires.
- Effet immédiat : la colorimétrie et les alertes dans AMDEC s’adaptent sans toucher aux formules.
Listes
- Rôle : fournir les menus déroulants (échelles 1–5 pour S/O/D, statuts, options de maîtrise, Oui/Non/NA…).
- Vous remplissez : rarement ; vous pouvez enrichir ou renommer les listes si besoin.
- Effet : cohérence des saisies, zéros fautes de typographie.
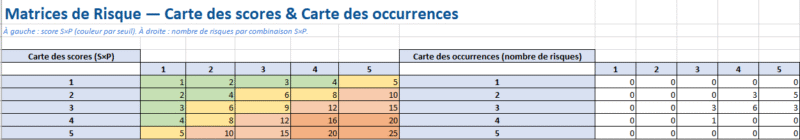
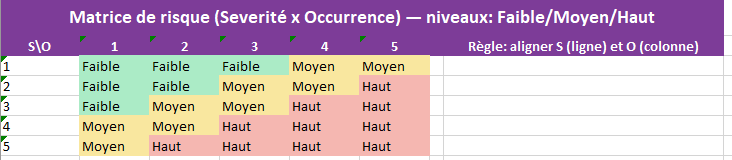
Matrice_Risque
- Rôle : table de lecture 5×5 « Sévérité × Occurrence » → niveau Faible / Moyen / Haut, colorée.
- Vous remplissez : rien au quotidien.
- Effet : les onglets AMDEC et Analyse_Risques s’y réfèrent pour afficher le niveau à partir de S & O.
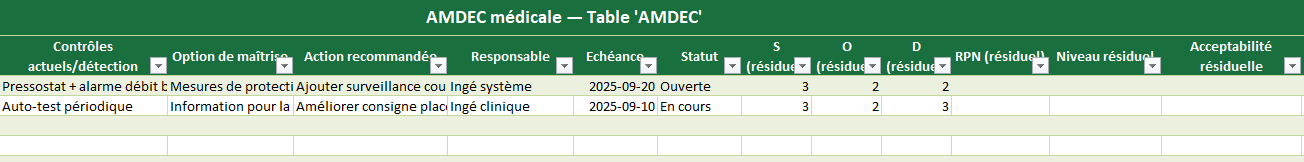
AMDEC
- Rôle : conduire l’AMDEC médicale (Mode de défaillance → Causes → Effets) et prioriser via RPN.
- Vous remplissez : les champs descriptifs, S/O/D (1–5), contrôles existants, actions, responsable, échéance, statut.
- Automatique :
RPN (initial) = S × O × DNiveau initial = Matrice_Risque(S,O)RPN (résiduel) = S × O × DNiveau résiduel = Matrice_Risque(S résiduel, O résiduel)- Couleurs vert/ambre/rouge selon les seuils Parametres
- Sortie : une priorisation claire des actions et un suivi date/responsable prêt pour la revue qualité.
Analyse_Risques
- Rôle : structure ISO 14971 « danger → situation dangereuse → séquence d’événements → atteinte » + options de maîtrise.
- Vous remplissez : les champs d’analyse, S/O initial et résiduel, l’option de maîtrise (sécurité intrinsèque / protections / information), l’acceptabilité, le statut.
- Automatique : Niveau initial et Niveau résiduel issus de la Matrice_Risque.
- Sortie : trame d’acceptation du risque résiduel et lien vers les preuves.
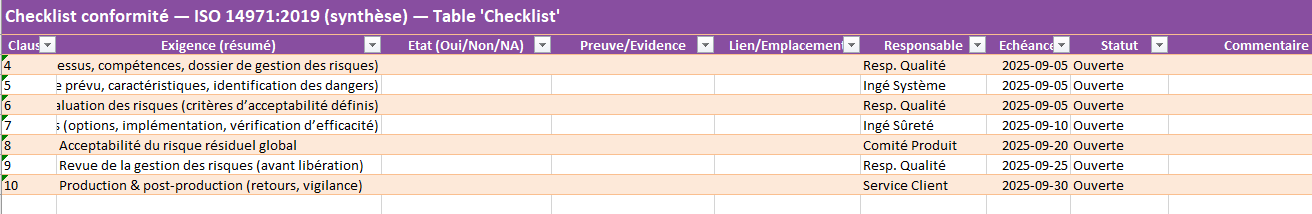
Checklist_Conformite
- Rôle : balayer les clauses 4 → 10 d’ISO 14971 (processus, évaluation, maîtrise, revue, post-market).
- Vous remplissez : pour chaque exigence, État (Oui/Non/NA), Preuve, Responsable, Échéance, Statut, Commentaire.
- Sortie : tableau de pilotage des conformités/pré-requis auditeurs.
Procedure
- Rôle : pas à pas & RACI (qui Réalise, qui Approve, qui Consulte, qui Informe), avec les livrables et les onglets concernés.
- Vous remplissez : les adaptations à votre organisation.
- Sortie : plan d’exécution cohérent et partagé.
3) Ce qui est automatisé (sans macros)
- Vraies tables Excel (bordures bleues) : quand vous ajoutez une ligne dans la table, les formules se recopient automatiquement.
- Références structurées : formules lisibles (ex.
=[@[S]]*[@[O]]*[@[D]]) qui résistent aux insertions de colonnes/lignes. - Mise en forme conditionnelle :
- RPN initial & résiduel colorés (seuils Parametres)
- Niveaux Faible/Moyen/Haut colorés par la Matrice_Risque
- Listes déroulantes partout : échelles S/O/D, Statut, Acceptabilité, Option de maîtrise, Oui/Non/NA — pour standardiser les entrées.
- Exemples fournis : quelques lignes d’AMDEC et d’Analyse_Risques illustrent la logique attendue.
4) Mode d’emploi en 5 minutes
- Ouvrez Parametres → vérifiez/ajustez vos seuils RPN et la politique d’acceptabilité.
- Allez dans AMDEC → saisissez S/O/D, ajoutez les actions, affectez responsable + échéance.
- Passez à Analyse_Risques → décrivez dangers/situations/atteintes, notez S/O initial puis résiduel après maîtrise.
- Validez au fil de l’eau dans Checklist_Conformite : État, Preuves, Statuts et dates.
- Pilotez avec Procedure (RACI) pour ancrer la cadence de travail et de revue.
5) Pièges à éviter
- Ne pas “tout miser” sur le RPN : une sévérité élevée appelle une action même si l’occurrence est faible.
- Distinguer occurrence de défaillance et probabilité d’atteinte (logique ISO 14971).
- Prouvez l’efficacité des maîtrises (pas seulement leur implémentation).
- Gardez la traçabilité : utilisez les colonnes Preuve/Lien et Trace/Exigences pour relier REQ, TST, V&V, CAPA.
- Saisissez toujours dans la table (pas sous les tableaux) pour conserver l’auto-remplissage.
6) Ce que vous pouvez personnaliser sans douleur
- Seuils et politique : Parametres.
- Libellés de listes (statuts, options de maîtrise) : Listes.
- Grille d’évaluation : adapter la Matrice_Risque si vos définitions internes diffèrent (ex. Haut plus strict).
7) Mini-glossaire express
- AMDEC (FMEA) : méthode d’analyse Mode de défaillance → Causes → Effets, avec priorisation RPN.
- RPN : Risk Priority Number = S × O × D (indicateur de priorisation, pas un verdict d’acceptabilité).
- ISO 14971 : norme de gestion des risques pour dispositifs médicaux, couvrant tout le cycle de vie.
- RACI : matrice d’affectation des rôles (Réalise, Approve, Consulte, Informe).
8) En un clin d’œil : ce que vous gagnez
- Un cadre unique pour l’analyse et la conformité.
- Des saisies guidées et calculs automatiques qui réduisent les erreurs.
- Une traçabilité nette, intelligente et audit-ready.
Guide pas-à-pas pour réussir la norme ISO 14971:2019
Afin de se conformer à l’ISO 14971:2019 — gestion des risques des dispositifs médicaux, chaque étape indique le but, les actions clés et les preuves attendues dans le dossier de gestion des risques (Risk Management File, RMF).
1) Gouvernance & politique de gestion des risques
But : poser les règles du jeu, les rôles et l’acceptabilité du risque.
Actions
- Nommer un Responsable gestion des risques (interface Qualité, Affaires Réglementaires, Clinique, Ingénierie, Production, SAV).
- Rédiger/valider la Politique et les critères d’acceptation du risque (matrice S×P, seuils, exigences de balance bénéfices/risques).
- Aligner avec l’ISO 13485 (processus conception, changements, SAV, PMS, CAPA).
Preuves : Politique signée, matrice de risque, RACI.
2) Plan de gestion des risques (par produit)
But : définir “comment” vous allez appliquer 14971 pour ce dispositif.
Actions
- Rédiger le Risk Management Plan (RMP) : portée du produit/versions, interfaces (IEC 62366-1, 62304…), échelles de Sévérité/Probabilité, méthodes d’estimation, critères d’acceptation, vérifications, revues, production & post-production (P/PP).
Preuves : RMP approuvé, versionné.
3) Dossier de gestion des risques (RMF)
But : constituer le référentiel de preuves.
Actions
- Structurer un RMF unique (eQMS) : index, traçabilité exigences ↔ risques ↔ contrôles ↔ tests ↔ IFU/étiquetage.
Preuves : Index RMF, localisation des documents sources.
4) Définir l’utilisation prévue & raisonnablement prévisible
But : cadrer le contexte réel d’utilisation.
Actions
- Décrire utilisateurs, environnements, indications, contre-indications, performances essentielles, utilisations erronées prévisibles.
Preuves : Fiche d’utilisation prévue, liens vers dossiers clinique/marketing.
5) Caractéristiques liées à la sécurité
But : lister ce qui peut affecter la sécurité tout au long du cycle de vie.
Actions
- Recenser caractéristiques et conditions influentes (électrique, mécanique, chimique/biocompatibilité, logiciel/cyber, stérilisation, emballage, transport, maintenance, élimination).
Preuves : Inventaire des caractéristiques avec sources (normes d’aptitude à l’usage, 10993, 60601/IEC applicables, etc.).
6) Identification des dangers → situations dangereuses → dommages
But : cartographier les risques “du monde réel”.
Actions
- Identifier dangers (intrinsèques et induits), séquences d’événements plausibles → situations dangereuses → dommages potentiels (patients, utilisateurs, tierces parties).
Preuves : Table “Danger → Séquence → Situation → Dommage”.
7) Estimation du risque initial (avant maîtrise)
But : objectiver le niveau de risque.
Actions
- Attribuer Sévérité (S) et Probabilité d’occurrence du dommage (P) selon le RMP.
- Calculer/positionner le niveau de risque (grille S×P).
Preuves : Colonne S, P, R_init documentées + justification (données, littérature, essais, avis d’experts).
8) Évaluation du risque vs critères d’acceptation
But : décider où agir.
Actions
- Comparer chaque R_init aux seuils (acceptable / tolérable sous conditions / inacceptable).
- Marquer les risques à maîtriser et ceux nécessitant analyse bénéfice/risque.
Preuves : Statut d’acceptabilité, décisions signées.
9) Maîtrise des risques — analyse des options & sélection
But : réduire les risques de façon priorisée.
Actions (ordre de priorité imposé par 14971)
- Sécurité intrinsèque par conception (éliminer/réduire le danger)
- Mesures de protection (matérielles/techniques/organisationnelles)
- Informations pour la sécurité (IFU, étiquetage, formation)
- Justifier les options non retenues; définir les exigences de contrôle (mesurables).
Preuves : “Risk Control Option Analysis” (RCOA), exigences design/process.
10) Vérifier la mise en œuvre & l’efficacité des contrôles
But : prouver que les contrôles existent et fonctionnent.
Actions
- Vérification d’implémentation (rapports de test, preuves d’intégration logicielle/électronique, étiquetage).
- Validation d’efficacité quand pertinent (usability, clinique, performance essentielle).
Preuves : Protocoles/rapports, résultats conformes aux critères.
11) Estimer & évaluer le risque résiduel (par situation)
But : s’assurer que le risque résiduel est acceptable.
Actions
- Re-estimer S et P après contrôles → R_residuel.
- Si non acceptable : itérer (nouveaux contrôles) ou mener bénéfice/risque documenté.
Preuves : Table mise à jour, conclusions d’acceptation motivées.
12) Évaluer le risque résiduel global
But : vision “système”.
Actions
- Examiner l’ensemble des risques résiduels, interactions, cumul d’expositions, scénarios de défaillances combinées.
- Confirmer la balance bénéfices/risques du dispositif.
Preuves : Risk Management Report (RMR) signé (synthèse & conformité).
13) Information sur la sécurité & communication à l’utilisateur
But : transparence sur les risques résiduels.
Actions
- Intégrer dans l’IFU/étiquetage : avertissements, précautions, conditions d’utilisation, formation requise, contre-indications, résiduels significatifs.
Preuves : IFU final, fiches de formation, revues règlementaires.
14) Production & post-production (PMS, vigilance)
But : boucler la boucle après mise sur le marché.
Actions
- Définir les sources de données : réclamations/SAV, retours terrain, NCR, CAPA, maintenance, littérature, bases d’alertes, surveillance concurrente.
- Mettre en place indicateurs, seuils de signal et réactions (enquête, FSCA si besoin).
- Réinjecter les enseignements dans le RMF (mise à jour vivante).
Preuves : Plan PMS, enregistrements, analyses de tendance, mises à jour RMF.
15) Gestion des changements & re-évaluation
But : conserver la maîtrise dans la durée.
Actions
- Tout changement (conception, matière, logiciel, procédé, fournisseur, étiquetage, usage) déclenche une évaluation de risque (impacts S/P, contrôles, tests).
Preuves : Dossiers de changement reliés au RMF, décisions d’acceptation.
Modèle de table “analyse & maîtrise des risques”
| ID | Danger | Séquence d’événements | Situation dangereuse | Dommage | S | P | R_init | Contrôle(s) (priorité 1→3) | Vérif implémentation | Efficacité | S’ | P’ | R_residuel | Acceptable ? | B/R requis ? | Réf. preuve |
|---|
- S : Sévérité (p. ex. 1 = mineur … 5 = catastrophique)
- P : Probabilité d’occurrence du dommage (pas seulement de la défaillance)
- S’/P’ : après maîtrise
Échelles & critères (exemple à adapter dans le RMP)
- Sévérité : 1 (inconfort) · 2 (réversible) · 3 (hospitalisation) · 4 (lésion grave) · 5 (décès)
- Probabilité : 1 (improbable) · 2 (rare) · 3 (occasionnelle) · 4 (probable) · 5 (fréquente)
- Acceptation :
- Vert : acceptable, suivi PMS standard
- Jaune : tolérable si bénéfice > risque + info/surveillance renforcées
- Rouge : inacceptable → contrôle supplémentaire ou conception à revoir
Contrôles de conformité (checkpoints)
- Politique & RMP approuvés, cohérents avec ISO 13485.
- Traçabilité complète (danger → contrôle → test → IFU).
- Priorisation des options de maîtrise respectée (conception > protections > info).
- RMR signé (risque résiduel global acceptable, bénéfice/risque justifié).
- Boucle P/PP active (PMS, vigilance, CAPA) avec mises à jour du RMF.
- Preuves archivées, contrôlées, versionnées.
Astuce d’auditeur
Lors d’un audit, on choisit 3–5 risques majeurs et on suit le fil de la preuve : du danger initial jusqu’à l’IFU et aux données post-market. Si chaque maillon est solide (analyse, maîtrise, test, communication, suivi), votre conformité ISO 14971:2019 tient.