Validation des procédés de fabrication : Modèle Téléchargeable
Recommandés
Cet article explore en profondeur les étapes, les méthodes, et les exigences pour la validation des procédés de fabrication.
💡
La validation des procédés de fabrication est une étape cruciale dans l’industrie, en particulier dans les secteurs où la qualité et la conformité sont impératives, comme dans les industries pharmaceutique, alimentaire, cosmétique, et des dispositifs médicaux. Ce processus vise à s’assurer que les procédés utilisés pour fabriquer un produit sont capables de produire des résultats constants et conformes aux spécifications prédéfinies.
Qu’est-ce que la validation des procédés ?
La validation des procédés est un processus systématique de collecte et d’analyse de données, basé sur la conception, le développement, et la production, afin de garantir que les procédés de fabrication peuvent produire de manière répétée un produit qui répond aux normes de qualité. Elle est généralement requise par les agences réglementaires, telles que la FDA (Food and Drug Administration) aux États-Unis ou l’ANSM (Agence Nationale de Sécurité du Médicament et des Produits de Santé) en France.
Pourquoi la validation des procédés est-elle essentielle ?
La validation des procédés offre plusieurs avantages, notamment :
- Qualité constante : Assurer que chaque lot de production est conforme aux spécifications, réduisant ainsi les variations et les risques d’erreurs.
- Conformité réglementaire : Répondre aux exigences des autorités de réglementation, ce qui est essentiel pour obtenir l’autorisation de mise sur le marché des produits.
- Efficacité économique : Réduire les coûts liés aux rejets de produits non conformes, aux rappels, et aux révisions de processus.
- Réduction des risques : Identifier et maîtriser les points critiques du processus qui pourraient entraîner des défaillances ou des non-conformités.
Les étapes de la validation des procédés
La validation des procédés se décompose en plusieurs phases clés, qui sont généralement les suivantes :
1. Qualification du design (DQ – Design Qualification)
La qualification du design est la première étape de la validation. Elle consiste à documenter et à vérifier que les équipements et les systèmes de production sont conçus en conformité avec les exigences réglementaires et les besoins du processus.
2. Qualification de l’installation (IQ – Installation Qualification)
La qualification de l’installation vise à s’assurer que tous les équipements et systèmes sont correctement installés selon les spécifications du fabricant et les exigences du processus. Cela inclut la vérification des connexions électriques, des systèmes de commande, et des dispositifs de sécurité.
3. Qualification opérationnelle (OQ – Operational Qualification)
La qualification opérationnelle consiste à tester les équipements dans les conditions d’exploitation normales pour s’assurer qu’ils fonctionnent conformément aux spécifications. Cette phase implique des tests de performance, des tests de fonctionnement sous charge, et des vérifications des systèmes d’alarme.
4. Qualification de la performance (PQ – Performance Qualification)
La qualification de la performance est l’étape où le processus de fabrication est testé en conditions réelles de production, souvent sur plusieurs lots de production. L’objectif est de démontrer que le processus produit de manière constante des produits conformes aux spécifications.
Les méthodologies de validation
Pour valider un procédé de fabrication, plusieurs méthodologies peuvent être utilisées, notamment :
- Analyse des risques : Utiliser des outils comme l’analyse des modes de défaillance, de leurs effets et de leur criticité (AMDEC) pour identifier les points critiques du processus.
- Études de capabilité : Évaluer la capacité du processus à produire dans les limites de tolérance spécifiées.
- Plans d’expérience (DOE – Design of Experiments) : Utiliser des plans expérimentaux pour identifier les paramètres critiques et optimiser le processus.
- Contrôle statistique des procédés (SPC – Statistical Process Control) : Mettre en œuvre des outils statistiques pour surveiller et contrôler le processus pendant la production.
Documentation et maintien de la validation
Une documentation rigoureuse est essentielle tout au long du processus de validation. Chaque étape doit être documentée, avec des enregistrements précis des tests effectués, des résultats obtenus, et des conclusions tirées. Une fois la validation initiale terminée, il est nécessaire de maintenir la validation au fil du temps, ce qui implique des activités de revalidation périodique et la gestion des changements.
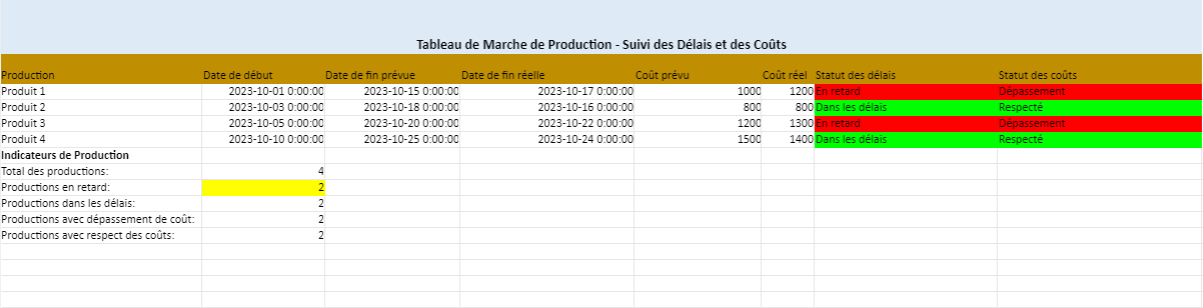
Voici un modèle de rapport de validation des procédés de fabrication. Ce modèle peut être adapté en fonction des exigences spécifiques de votre entreprise ou de l’industrie concernée.
RAPPORT DE VALIDATION DES PROCÉDÉS DE FABRICATION
1. Introduction
1.1. Objectif
Décrire l’objectif de la validation du procédé, y compris la raison pour laquelle cette validation est nécessaire (conformité réglementaire, assurance qualité, etc.).
1.2. Portée
Définir la portée de la validation, y compris les procédés, les équipements, et les produits concernés.
1.3. Références
Lister les documents, normes et réglementations de référence utilisés pour la validation (ex. : FDA, EMA, ICH Q7).
1.4. Responsabilités
Indiquer les rôles et responsabilités des différentes parties prenantes dans la validation (équipe qualité, production, ingénierie, etc.).
2. Description du Procédé
2.1. Résumé du procédé
Fournir une description détaillée du procédé de fabrication, y compris les étapes clés et les paramètres critiques.
2.2. Équipements utilisés
Lister les équipements impliqués dans le procédé, avec leurs numéros de série et leurs spécifications.
2.3. Matières premières
Détailler les matières premières utilisées, y compris les spécifications et les fournisseurs.
3. Plan de Validation
3.1. Stratégie de Validation
Expliquer la stratégie de validation choisie (ex. : prospective, rétrospective, concomitante), y compris les critères d’acceptation.
3.2. Étapes de validation
Décrire les étapes spécifiques de la validation, incluant la qualification du design (DQ), la qualification de l’installation (IQ), la qualification opérationnelle (OQ), et la qualification de performance (PQ).
3.3. Méthodologie
Détailler les méthodes utilisées pour la validation (ex. : analyse de risque, capabilité des procédés, contrôle statistique).
3.4. Échantillonnage
Décrire le plan d’échantillonnage, y compris la taille des échantillons et la fréquence des tests.
4. Résultats de la Validation
4.1. Qualification du Design (DQ)
Résumer les résultats de la qualification du design, y compris la conformité aux exigences de conception.
4.2. Qualification de l’Installation (IQ)
Présenter les résultats de la qualification de l’installation, incluant les tests de conformité et les écarts identifiés.
4.3. Qualification Opérationnelle (OQ)
Détailler les résultats de la qualification opérationnelle, avec des tableaux de données et des analyses des résultats.
4.4. Qualification de Performance (PQ)
Présenter les résultats de la qualification de performance, y compris les performances du procédé dans des conditions réelles de production.
4.5. Analyse des Déviations
Documenter toutes les déviations par rapport au plan de validation initial, avec une analyse des causes, des impacts, et des actions correctives mises en place.
5. Conclusions
5.1. Résumé des Résultats
Fournir un résumé des résultats obtenus, indiquant si les critères d’acceptation ont été respectés.
5.2. Conformité aux Spécifications
Confirmer si le procédé validé est capable de produire de manière répétée des produits conformes aux spécifications prédéfinies.
5.3. Recommandations
Formuler des recommandations pour le maintien de la validation, y compris des suggestions pour des tests supplémentaires ou une revalidation périodique.
6. Approbations
6.1. Signatures
Inclure les signatures des parties responsables de la validation, y compris les dates de signature.
- Responsable de la Qualité : _____________ Date: _
- Responsable de la Production : _________ Date: _
- Responsable de l’Ingénierie : ___________ Date: _
7. Annexes
7.1. Données Brutes
Inclure toutes les données brutes, graphiques, et autres documents pertinents.
7.2. Protocoles et SOPs
Annexer les protocoles de validation et les procédures opératoires normalisées (SOPs) référencés dans le rapport.
Ce modèle est une base solide pour créer un rapport de validation des procédés de fabrication. Il est important d’adapter ce modèle en fonction des besoins spécifiques de votre entreprise et de la réglementation applicable.