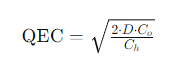Cours Dessin Industriel : TRAITEMENT THERMIQUE PRÉLIMINAIRE
Le traitement thermique preliminaire des minerais ont pour role essentiel d’opérer une transformation chimique, donnant un produit inter-médiaire plus propre à l’élaboration du métal dans l’appareil métallurgique proprement dit.Nous n’envisagerons que les deux traitenents les plus impor tants:calcination des carbonates et grillage des sulfures.Ils conduisent a des produits pulvérulents qui sont le plus souvent agglomérés par briquettage ou frittage.
I.-CALCINATION DES CARBONATES
transformation chimique, donnant un produit inter-médiaire plus propre à l’élaboration du métal dans l’appareil métallurgique proprement dit.Nous n’envisagerons que les deux traitenents les plus impor tants:calcination des carbonates et grillage des sulfures.Ils conduisent a des produits pulvérulents qui sont le plus souvent agglomérés par briquettage ou frittage.
I.-CALCINATION DES CARBONATES
La dissociation thermique des carbonates sous l’effet d’une élévation de température est désignée en métallurgie sous le nom de calcination.
Cette dissociation est limitée par la réaction inverse et, pour une tempé-rature donnée T,l’équilibre :
MCO2MO+CO2
est caractérisé par une constante K, précisément égale à la pression du dioxyde de carbone en équilibre avec le carbonate et l’oxyde : K, = pco,.
Théoriquement,pour que la dissociation se poursuive de façon continue à la température T, il suffit que la pression partielle du dioxyde de carbone dans l’atmosphère du four dépasse la pression de CO2 dans l’atmosphère qui est très faible. Mais pour que la réaction soit rapide, il faut que les gaz sortants soient aisément entrainés hors du four, résultat atteint si pco,et par suite T, sont suffisamment élevés, la réaction de dissociation étant endothermique.
Intérêt de la calcination.
La calcination ramène la métallurgie d’un carbonate à celle d’un oxyde1 :
MCO3→MO+CO2.
1.Tous les carbonates métalliques,sauf les carbonates alcalins et BaCO2,sont,en effet. décomposables par la chaleur,sous la pression atmosphérique normale.
CHAUSSIN-HILLY.-Metallurgie-II.
réactions secondairos.
indispensable, présento de sérieux avantagos. demment augmonto par lo dópart du dioxyde de carbone et de l’eau d’humi dan: il en rdalto, dventuollomont, uno diminution des frais de transport et une augmentation du rendement de l’appareil métallurgique.
o composé obtonu étant poreux ost en général plus faible à réduire. e) II peut y avoir épuration partielle du minerai par élimination plus ou moins complète du soufre à l’état de SO2.
d) Dans la métallurgie du zinc, le départ du dioxyde de carbone (oxygé. nant à température élevée) favorise la réduction de l’oxyde ZnO qui, autre. ment ne sorait possible qu’au prix d’une augmentation de la consommation
de coke. e) On remarque que, sous des pressions égales, les températures théoriques de début de dissociation thermique des différents carbonates se répartissent dans un vaste intervalle. Voici des nombres concernant quatre carbonates.
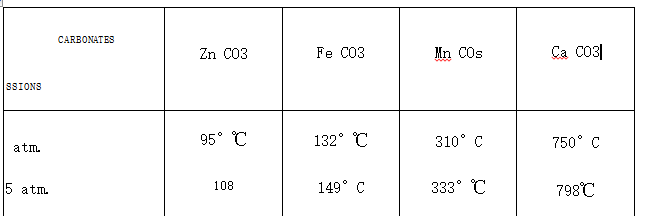
On peut ainsi prévoir certaines possibilités de traitements. C’est ainsi que pour un carbonate métallurgique à gangue calcaire, on peut à volonté obtenir le mélange MO+ CaO, ou MO + CaCOз en jouant sur la température du four.
Calcination des carbonates de fer.
Réaction de calcination.- Le carbonate de fer se décompose sui-vant la réaction:
Fe CO3→CO2+FeO
Il y aurait avantage, au point de vue dépense ultérieure de carbone, à в’en tenir à l’oxyde ferreux ; mais on ne peut empêcher son oxydation immé-diate en oxyde ferrique Fe2O3 ou en oxyde magnétique FesO4, par l’air ou par le dioxyde de carbone.
La marche du four à cuve implique normalement un excès d’air; le dioxyde de carbone reste inaltéré, et les deux réactions possibles sont:
2FeO+1/2O2→Fe2O3
3FeO+1/2O2→Fe3O4.
Le passage de FeзO4 à Fe2O3 se fait selon l’équation :
4 Fe3O4+O2→6Fe2O3 ΔG°=-119250+67,25 T.
Si, en première approximation, on suppose que ΔG et ΔG° sont égaux, on voit que, pour des températures de l’ordre de 700 K, ΔG° est négatif. La théorie prévoit donc la formation de Fe2O3, en accord avec l’expérience.
L’équation globale de calcination est donc:
2 FeCO3+1/2O2→Fe2O3+2 CO2,
ΔG°=-40510-57 T.
Thermicité de la réaction.
La réaction semble exothermique, puisque ΔH est négatif (-40 510 cal pour 2 moles de FeCO3). Mais ce terme suppose que les produits entrants et les produits sortants sont à la même température, température que l’on peut prendre égale à la température des produits entrants Te. A la valeur de ΔH, il faut donc ajouter la variation d’enthalpie des produits sortants entre Te et leur température de sortie Ts. Il faut aussi faire intervenir les pertes dues aux échanges de chaleur entre le four et le milieu ambiant.
Pratiquement la calcination du carbonate defer consomme de 6 à 10 kg de houille par tonne de minerai.
Fours de calcination des carbonates
Les appareils de calcination des carbonates sont des fours à cuve. Un
tel four, à axe vertical, reçoit les matières à traiter à sa partie supérieure
appelée gueulard, et les produits de l’opération sortent
à la partie inférieure. Le chauffage est obtenu généra-
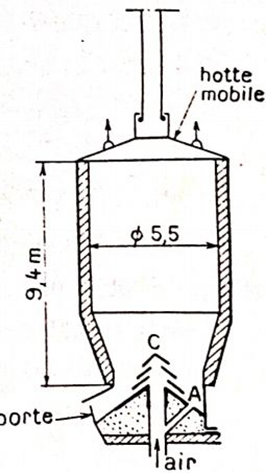
lement en chargeant par le gueulard un combustible
solide en couches alternées avec les produits à traiter;
on utilise parfois du gaz de haut fourneau ou de gazo-
gènes. L’air est soufflé à la partie basse de l’appareil.
Les fours ont une forme cylindrique ou tronconique. 9,4m
La calcination est conduite progressivement avec excès
d’air, à une température voisine de 400 °C. Une éléva-
tion de température provoquerait une agglomération
et une scorification du minerai. porte-
La figure 4.1 représente un four moderne utilisé à La Ferrière-aux-Étangs (Orne); il calcine environ
GRILLAGE DES SULFURES
GRILLAGE DES SULFURES
4.4.Les réactions de grillage des sulfures.
)Utilisation des minerais sulfurés. – On a ru (1.7) qu’arant dttre soumis aux treitemenis métallurgigues proprement dits, les minerais saltures sont, le plus souvent, transfonnés en ongides et en saljates.Cette trensiormation est réalisse par Fopération du grillage gui consiste essentiel. Iement a soumettre le minerai a l’action orydante de I’air a haute tempéra.
ture.
Par grillage,on peut done obtenir à partir d’un sulfure MS, soit :
a) un cayde MO (grillage a mort).Par la suite, cet oxyde pourra être réduit pour donner le métal:
(1)
MO÷R→RO÷M
ou encore 2MO÷MS→SO2+3M
(2)
ou b) un suljate ISO4 (gillage suljatisant), le plus souvent amené en solution aqueuse en vue d’une électrolyse ultérieure.
2) Obtention des ozydes:
a) Par oaydation directe.-La réaction :
(3)
2MS÷302→2M0+SO2
prédomine å température élevée (0 > 800℃); elle est favorisée par l’éva-cuation rapide du dioxyde de soufre du four de grillage1.
b) Par décomposition d’un sulfate intermediaire:
(4)
(5)
2MS+402→2MSO; 2 MSO;→2M0+SO2+1/202
En raison de la grande affinité du soufre et des métaux pour l’oxygène, les réactions(3) et (4) sont nettement exothermiques et commencent à des températures relativement basses (de 200 å 450 °C).
La dissociation du sulfate demande toujours une température plus élevée dans les conditions industrielles courantes : 600°C pour Fez(SO4)a,800℃pour ZnSO4, plus de 1 000°℃ pour le PbSO4.
1.On cherche parfcis å ne réaliser qu’un grillage partiel en vue de P’élaborationdu métal par la réaction (2), le produit final du grillage est alors MO+MS.
Obtention des sulfates.
a) On peut griller le sulfure à basse température en laissant l’oxyde métallique au contact du dioxyde de soufre et d’un excès d’air dans le four (il faut alors que la pression partielle de SO2 dans le four soit supérieure à la pression d’équilibre de la dissociation du sulfate, pour éviter celle-ci). b) Le même résultat peut être obtenu en grillant rapidement le sulfure vers 950 °℃; l’oxyde produit, ramené à basse température en atmosphère oxydante riche en dioxyde de soufre, se transforme en sulfate ; c’est ce qui se passe lors du grillage en suspension
4 bis. Pratique du grillage.
1.Suite des phénomènes.
1) La dessiccation du minerai commence avant 100 °C, elle se poursuit parfois jusqu’à 550 °℃ (cas des minerais avec eau de constitution).
2)La dissociation des carbonates de la gangue se produit (éventuelle-ment) à partir de 200 °C.
3)L’inflammation des sulfures se produit à partir de 200 °C à des tem-pératures variant avec la nature du minerai et la finesse des grains. Au-des-sous de 650 °C, il se forme surtout des sulfates ; au-dessus de 750 °C, la formation des oxydes prédomine. La composition de l’atmosphère du four (SOs,SO2, O2) peut modifier, pour une même température, les proportions des oxydes et des sulfates.
4) La décomposition des sulfates est pratiquement totale au-dessus de 1 000 °C. Le produit grillé est alors formé d’oxydes.
2.Bilan thermique.
La dessiccation du minerai et la dissociation des carbonates absorbent de la chaleur. Le bilan des phases (3) et (4) est positif, l’ensemble des réactions dégageant de la chaleur. Finalement, et en tenant compte des pertes par fuites thermiques à partir du four, on peut distinguer deux cas.
a) Le bilan thermique total (chaleur de réaction industrielle) est positif.-Cela signifie que le grillage, une foisamorcé, se continue de lui-même, sans qu’il soit nécessaire de faire un apport extérieur de chaleur. Le grillage est dit autogène, le minerai grillé est dit autocombustible. Pour qu’il en soit ainsi, deux conditions sont nécessaires :
1) Le minerai doit être riche et la chaleur de formation de l’oxyde MO, élevée;
2) La température de dissociation du sulfate MSO4 doit être relativement basse. Pratiquement, seules les pyrites de fer et les blendes riches sont auto-combustibles. On arrive couramment, par grillage autogène ordinaire, à des pourswive, 1l fast dome peeror au appont de combustible et un dispomait upplimentaite de combuation.
3.Fours de grillage.
Actuiellement un lowr de grillage doit non seulement résliser loxydation du minerai de lagon a chtemir les produita désirés (oxydes ou sulfatea) dana les meilleutes conditiona,mais il doit anaai perrmettre la récupération aigée du dioxyde de soutre (labrieation de l’acide sulfurigue) et la récupération maximale des qgNantités de chalenr.
a) Renuperasion du dissgde de soufre,-Elle ne présente pas de difficultes dans le cax des minerais autocombuatibles. Il ya lieu,cependant, de prévoir un dépouasibrage soigné des gaz qoi peuvent contenir de 10 & 40% de la masss grillés sous tone de ponasieres; celles-ci sont séparées á laide de précipitateurs élecsrostatiques ou d’épurateurs (7. 14).
Par contre,dans le cas des minerais non antocombustibles (blendes),le lour doit comporter deux circuits d’évacuation des gaz : l’un pour le départ des produits de combuation du combustible (CO2,O2,N2),I’autre pour les produits du grillage (SO2, SOs, Na,O2).Cette précaution est indispensable en ralson des difficultés que présente la séparation des dioxydes CO2 et SO2 (exemple: four Spirlet).
b) Récupération des guantités de chaleur. -En s’inspirant des techniques du chauflage au charbon pulvérisé, on a été conduit å considérer le minerai sulfuré comme un véritable combustible : réduit en fine poussière, on l’en-lamme dans un oourant d’air. Il en résulte une meilleure utilisation de l’air comburant et une elévation de la température des gaz de grillage.Leur chaleur sensible est récupérée, d’abord pour la production d’importantes quantites de vapeur; puis, dans un deuxiéme stade, on peut l’utiliser pour préchaufler l’air de combustion ou de grillage.
On ambliore encore ces résultats en substituant de l’air enrichi en oxygène (30% Oz) à P’air atmosphérique.
c)Ces diverses considérations ont entrainé la construction de nombreux appareils de grillage que l’on peut classer ainsi:
1.Yours à soles multiples a ráblage mécanique (utilisés surtout pour les minerais autocombustibles);
2. Yourm à moufle (pour mínerais non autocombustibles); 3.Convertianeurs;
4.Yours rotatifa;
5.Yourg de fluidiaation.